
【题目】化学无处不在,下列说法不正确的是![]()
A.硅既可制作光导纤维,也可制作电脑芯片
B.乙酸既可做调味剂,也可除水垢
C.氢氧化铝既可做阻燃剂,也可治疗胃酸过多
D.食盐既可做融雪剂,也可做防腐剂
【答案】A
【解析】
A.电脑芯片是硅,光导纤维成分是二氧化硅;
B.乙酸具有弱酸性;
C.氧化铝可以用做耐火材料;
D.食品防腐剂是指保持食品原有的质量和食品营养价值为目的食品添加剂,它能抑制微生物的生长和繁殖;调味剂是指改善食品的感官性质,使食品更加美味可口。
A.电脑芯片是硅,光导纤维成分是二氧化硅,故A错误;
B.乙酸具有弱酸性,乙酸的水溶液为食醋可以做调味剂,酸性比碳酸的酸性强,所以也可除水垢,故B正确;
C.氢氧化铝加热易分解生成氧化铝,所以氢氧化铝能用做耐火材料,氢氧化铝是弱酸也可以治疗胃酸过多,故C正确;
D.食盐可以改善食品的口感,可做调味品,也能抑制微生物的生长和繁殖,防止食物变质,可以做防腐剂,故C正确;
故选:A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
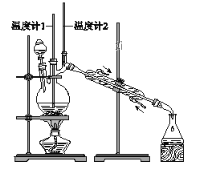
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
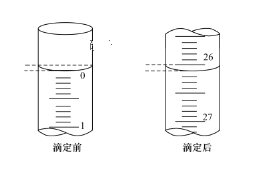
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
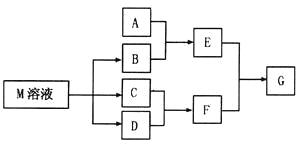
(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
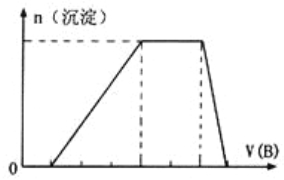
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验用所给实验装置可达到目的的是( )

选项 | 反应原理 |
A |
|
B | CH3COOH+(CH3)2CHCH2CH2OH |
C |
|
D | CH3CH2CH2CH2OH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) ![]() CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________(填“>”或“<”)0,△H1=________(用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
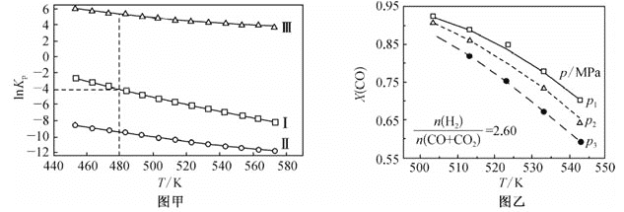
①反应(Ⅱ)的△H________(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制 ![]() =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大 ![]() ,X(CO)增大
,X(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
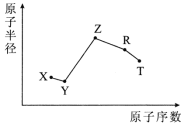
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是()
A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率
B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度
C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率
D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com