
分析 (1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(2)反应是放热反应降低温度平衡逆向进行,反应速率减小;
(3)反应是可逆反应不能进行彻底;
(4)反应焓变小于0,△H<0,反应前后气体体积减小熵变△S<0;
(5)反应条件的密闭容器中欲提高AB的转化率,应使平衡正向移动,据此回答.
解答 解:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,2A(g)+B(g)?2C(g),平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)c(B)}$,
故答案为:$\frac{{c}^{2}(C)}{{c}^{2}(A)c(B)}$;
(2)反应是放热反应,降低温度平衡逆向进行,平衡常数减小,化学反应速率减小,
故答案为:增大,减小;
(3)2A(g)+B(g)?2C(g)△H=-180kJ•mol-1,焓变是2molA和1molB完全反应生成2molC放热180KJ,在此条件下向此容器中充入2molA和过量的B,反应是可逆反应,充分反应后,放出的热量小于180KJ,
故答案为:<,该反应为可逆反应,有一定的限度,不能进行到底;
(4)反应焓变小于0,△H<0,反应前后气体体积减小熵变△S<0,选D,
故答案为:D;
(5)根据化学平衡:2A(g)+B(g)?2C(g)△H=-180kJ•mol-1,反应是气体体积减小的放热反应,欲提高AB的转化率,平衡正向进行;
A.向容器中按原比例再充入原料气,则压强增大,平衡向右移动,AB的转化率增大,故A正确;
B.向容器中再充入惰性气体,总压增大分压不变,则各组分浓度不变,平衡不移动,AB的转化率不变,故B错误;
C.改变反应的催化剂,不影响平衡的移动,AB的转化率不变,故C错误;
D.液化生成物分离出氨,平衡向右移动,AB的转化率增大,故D正确;
故答案为:AD.
点评 本题考查平衡常数表达、化学反应速率、影响化学平衡的因素与平衡状态的判断等,属于综合的考查,注意知识的归纳和整理是解题关键,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羟基、羧基;
;写出A分子中官能团的名称羟基、羧基; ;
;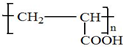 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键 共价键 | 强氧化性 | 消毒剂 |
| B | H2O2 | 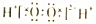 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 给碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液 | 验证酸性: 盐酸>碳酸>苯酚 |
| D | 氯乙烷和氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液 | 验证产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
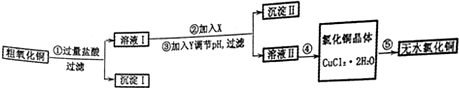
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车安全气囊一般由传感器、气囊、气体发生器等组成.
汽车安全气囊一般由传感器、气囊、气体发生器等组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ | |
| B. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)-259.92kJ | |
| C. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)-1299.6kJ | |
| D. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com