
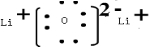 ,故答案为:
,故答案为: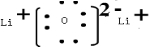 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
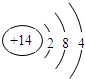
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所处的周期序数:C=N<Si |
| B.原子半径:Si>C>N |
| C.最高化合价:Si>C>N |
| D.非金属性:N>C>Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg、Al原子最外层电子数依次增多 |
| B.P、S、Cl元素最高正化合价依次增大 |
| C.N、O、F得电子能力依次减弱 |
| D.Li、Na、K的电子层数依次增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3o | 一60.75 |
| H2Se | 1.47 | 91.0o | 一41.50 |
| 编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com