
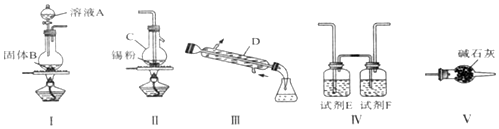
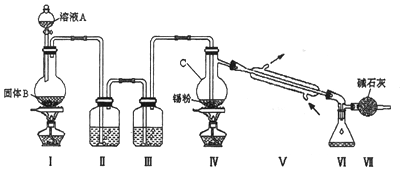
分析 由装置图可知装置Ⅰ应为制备氯气装置,离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,装置E为饱和食盐水,装置F为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅱ中反应生成SnCl4,经冷却后在装置Ⅲ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中,通过连接装置V来实现,
(1)仪器图形和作用可知为蒸馏烧瓶;
(2)该实验中先制备氯气,氯气经除杂,干燥后与锡在装置Ⅱ中反应生成SnCl4,经冷却后在装置Ⅲ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中;
(3)碱石灰可以吸收空气中水蒸气防止空气中的水蒸气进入装置E中,使SnCl4水解;
(4)若无装置V存在,则在氯气中含有水蒸汽,SnCl4水解产生的含锡的化合物;
(5)若Ⅱ中用去锡粉5.95g,则n(Sn)=$\frac{5.95g}{119g/mol}$=0.05mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.05mol×261g/mol=13.05g,产率=$\frac{实际产量}{理论产量}$×100%;
解答 解:(1)由装置图可知仪器C为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)该实验中先制备氯气,氯气经除杂,干燥后与锡在装置Ⅱ中反应生成SnCl4,经冷却后在装置Ⅲ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中,所以连接顺序是I→Ⅳ→Ⅱ→Ⅲ→V;
故答案为:I;Ⅳ;Ⅱ;Ⅲ;V;
(3)装置Ⅰ中这制得的氯气中含有氯化氢和水蒸气,装置E为饱和食盐水,除去氯化氢,装置F为浓硫酸,除去水蒸气;因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中,通过连接装置V来实现;
故答案为:吸收未反应的氯气;防止空气中的水蒸气进入装置Ⅲ内,使SnCl4水解;
(4)若无装置V存在,则在氯气中含有水蒸汽,所以在Ⅲ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物Sn(OH)4或SnO2;
故答案为:Sn(OH)4或SnO2;
(5)若Ⅱ中用去锡粉5.95g,则n(Sn)=$\frac{5.95g}{119g/mol}$=0.05mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.05mol×261g/mol=13.05g,所以反应后,Ⅲ中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为$\frac{12.0g}{13.05g}$×100%=92.0%,
故答案为:92.0%.
点评 本题考查物质的制备,涉及仪器的识别、氯气的实验室制取方法、实验操作的目的、盐类水解、物质产率的计算等知识,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
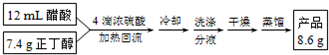
| 密度/(g•cm-3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.81 | 117.7 | 可溶 |
| 乙 酸 | 1.05 | 117.9 | 互溶 |
| 乙酸丁酯 | 0.88 | 126.3 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
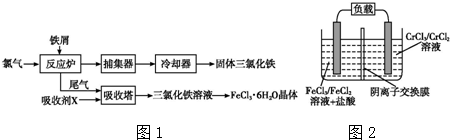
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
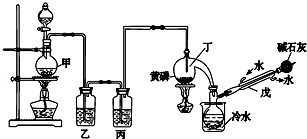
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露.”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 | |
| B. | 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是指铜可以采用湿法冶炼 | |
| C. | 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 | |
| D. | 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com