
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
取某铁的氧化物样品,用140mL 5 mol/L盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中的Fe2+ 完全转化为 Fe3+,该样品中可能的化学式是
A.Fe3O4 B.Fe4O5 C.Fe5O6 D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
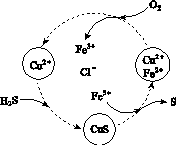
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:________________________________________。
(2)已知:
甲醇的脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃的反应
2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇的异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
(3)如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
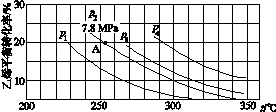
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=____________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为____,理由是___________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有________________________________________________________________________、
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O
(1)已知:Ⅰ反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ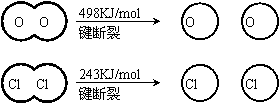

H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________KJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“若”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl平衡转化率影响的曲线。


①曲线b对应的投料比是______________.
②当曲线b, c, d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2 Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
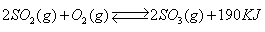
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
a.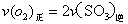 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO30.18mol,则 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析以下说法:①粗盐和碱石灰都是混合物;②天然气和水煤气都是可再生资源;③冰和水混合物不是混合物而是纯净物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和烧碱都是碱;⑦豆浆和雾都是胶体。上述说法正确的是
A.①③④⑦ B.①②⑤⑥ C.③⑤⑥⑦ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com