
 ,常用于汽水、糖果的添加剂.
,常用于汽水、糖果的添加剂.分析 有机物含有羧基,具有酸性,可发生中和、酯化反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生氧化反应和取代反应,以此解答该题.
解答 解:(1)由结构简式可知有机物含有羧基、碳碳双键,羟基,故答案为:羧基、碳碳双键,羟基;
(2)含有羟基和羧基,都可与钠反应,反应的方程式为3HOOCCH(ONa) CH=CH COOH+6Na→2NaOOCCH(ONa) CH=CH COONa+3H2↑,
故答案为:3HOOCCH(ONa) CH=CH COOH+6Na→2NaOOCCH(ONa) CH=CH COONa+3H2↑;
(3 )含有羧基,具有酸性,可与碳酸氢钠溶液反应生成二氧化碳气体,反应的方程式为HOOCCH(OH) CH=CH COOH+2NaHCO3→NaOOCCH(OH) CH=CH COONa+2CO2↑+2H2O,
故答案为:HOOCCH(OH) CH=CH COOH+2NaHCO3→NaOOCCH(OH) CH=CH COONa+2CO2↑+2H2O;
(4)含有羧基,可与乙醇发生酯化反应,方程式为HOOCCH(OH) CH=CH COOH+2CH3CH2OH$→_{△}^{浓硫酸}$CH3CHOOCCH(OH) CH=CH COOCH2CH3+2H2O,
故答案为:HOOCCH(OH) CH=CH COOH+2CH3CH2OH$→_{△}^{浓硫酸}$CH3CHOOCCH(OH) CH=CH COOCH2CH3+2H2O;
(5)醇羟基可被酸性高锰酸钾氧化,但碳碳双键也可被氧化,可取少量该有机物加入适当溴水,使碳碳双键完全反应,再加入少量酸性高锰酸钾溶液,溶液褪色则说明含有醇羟基,
故答案为:取少量该有机物加入适当溴水,使碳碳双键完全反应,再加入少量酸性高锰酸钾溶液,溶液褪色则说明含有醇羟基.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意羧酸、醇的性质,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
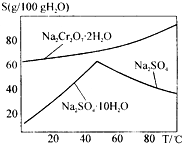 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 11.2L H2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子组成相差若干个CH2的两种有机物互为同系物 | |
| C. | 分子式相同的不同有机物一定是同分异构体 | |
| D. | 符合通式CnH2n+2的不同烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gH2 和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.75molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | KAl(SO4)2 | C. | NaHCO3 | D. | CH3COONa |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com