
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| C. | 氯水中放入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| D. | 1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
分析 A、氯气在化学反应中既可以做氧化剂,还可以做还原剂;
B、氯气不易溶于饱和食盐水,所以可以用排饱和食盐水的方法收集氯气;
C、氯气本身无漂白性,是次氯酸的漂白性;
D、状况不知,无法由体积求物质的量.
解答 解:A、氯气在和水以及强碱的反应中既做氧化剂,还做还原剂,故A错误;
B、氯气和水反应生成盐酸和次氯酸,饱和食盐水中含有氯离子,所以饱和食盐水抑制氯气溶解,则可以采用排饱和食盐水的方法收集氯气,故B正确;
C、氯气本身无漂白性,是次氯酸的漂白性,说明溶液中有次氯酸存在,故C错误;
D、状况不知,无法由体积求物质的量,故D错误;
故选B.
点评 本题考查了氯气的收集、氯元素的性质等知识点,易错选项是D,有关气体体积的计算要注意温度和压强,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| B. | 除去 CO2 中的 HCl 气体,只需将气体通过饱和的 Na2CO3 溶液 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含 SO42- | |
| D. | 将 0.1mol/L 的 AlCl3 溶液 100mL 逐滴加到 0.1mol/L 的 NaOH 溶液 200ml 中与将 0.1mol/L 的 NaOH 溶液 200ml 逐滴加到 0.1mol/L 的 AlCl3溶液 100mL中,发生的现象和产生沉淀一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量氯化钠的熔点 | B. | 测量固体氯化钠的导电性 | ||
| C. | 测量熔融氯化钠的导电性 | D. | 测量氯化钠水溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色原理相同 | |
| B. | 乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为 120° | |
| C. | 除去乙烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙烯和环丙烷( 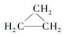 )的分子组成符合通式 CnH2n,因此它们属于同系物 )的分子组成符合通式 CnH2n,因此它们属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
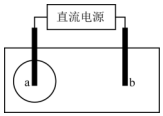 用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )
用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )| A. | 该试纸可能是pH试纸,b电极为正极 | |
| B. | 该试纸可能是pH试纸,b电极处亦出现一蓝色圆 | |
| C. | 该试纸可能是淀粉碘化钾试纸,b电极附近溶液pH变小 | |
| D. | 该试纸可能是淀粉碘化钾试纸,b电极处发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com