
(15��)���÷�����(��Ҫ�ɷ�ΪAl��������Fe��Si��)�ȿ���ȡ�л��ϳɴ���AlBr3�ֿ���ȡ��ˮ������������[A12(SO4)3?18H2O]��
I��ʵ������ȡ��ɫ����ˮAlBr3(�۵㣺97.5�棬�е㣺263.3��265��)������ͼ��ʾװ�ã�

��Ҫʵ�鲽�����£�
����l�����������飬��CCl4����Ƭ�̣����Ȼ��Ͷ�뵽��ƿ6�С�
����2���ӵ��ܿ�7���뵪����ͬʱ���ܿ�l��4�ſգ�һ��ʱ���رյ��ܿ�7��1�����ܿ�4��װ�����������ĸ���ܡ�
����3���ӵ�Һ©������һ������Һ������ƿ6�У�����֤��ƿ6������ʣ��
����4��������ƿ6������һ��ʱ�䡣
����5�������������������Ϊ�ӵ��ܿ�4�����ܿ�l����װ�����������ĸ�����뵼�ܿ�1���ӣ�����ƿ6������270�����ң�ʹ�廯����������ռ���2��
����6���������ʱ���ڼ���ͨ�뵪��������£����ռ���2��3�����£����������3����
��1������l�У�������CCl4���ݵ�Ŀ���� ��
��2������2�����У�ͨ������Ŀ���� ��
��3������3�У���ʵ��Ҫ��֤��ƿ��������ʣ����Ŀ���� ��
��4������Һ�巴Ӧ�Ļ�ѧ����ʽΪ ��
��5������4���ݺ��������жϿ���ֹͣ�������� ��
��6������5����ܿ�l��4������4ͨ��N2��Ŀ���� ��
II��ij����С���ͬѧ���÷�������ȡ���������壬��֪���������������ҺpH��ϵ��ͼ��ʾ��ʵ���п�ѡ�õ��Լ�����������������2.0mol?L-1NaOH��Һ��2.0 mol?L-1����

��7���������Ʊ������������ʵ�鲽������Ϊ��
�ٳ�ȡһ���������������ձ��У��ִμ���2.0 mol?L-1NaOH��Һ�����������ٲ�������Ϊֹ��
�ڹ��� �� ��
�ܹ��ˡ�ϴ�� �� ���� ��
����ȴ�ᾧ�� ����ˡ�ϴ�ӡ����
I����1����ȥ�����������֬���л��
��2���ų�װ���к�ˮ�����Ŀ�����
��3����֤Һ����ȫ��Ӧ����ֹ���������AlBr3�У�
��4��2Al+3Br2 2AlBr3��
2AlBr3��
��5��5�Ĺ��л���Һ����ɫ������ƿ6�����ʳ���ɫ����
��6����AlBr3��������װ��2�в�������
II����7������Һ��2.0 mol?L-1�����ڲ��Ͻ����µ���pH4����10���ң�
���ڳ����в��ϼ���2.0 mol?L-1���ᣬ������ǡ���ܽ⣻
������Ũ����
��������
���������I���������ʵ��װ�úͲ�����������ʵ����ʽ������𡣣�1������l�У�������CCl4���ݵ�Ŀ���dz�ȥ�����������֬���л����2������2�����У�ͨ������Ŀ�����ų�װ���к�ˮ�����Ŀ�������3������3�У���ʵ��Ҫ��֤��ƿ��������ʣ����Ŀ���DZ�֤Һ����ȫ��Ӧ����ֹ���������AlBr3�У���4������Һ�巴Ӧ�Ļ�ѧ����ʽΪ2Al+3Br2 2AlBr3����5������4���жϷ�Ӧ��ȫ����ֹͣ����������������Ϊ5�Ĺ��л���Һ����ɫ������ƿ6�����ʳ���ɫ������6������5����ܿ�l��4������4ͨ��N2��Ŀ���ǽ�AlBr3��������װ��2�в�������II����������֪����С���ͬѧ�÷�������ȡ�����������ԭ��Ϊ������������������2.0mol?L-1NaOH��Һ��Ӧ����ƫ�����ƣ�����2.0 mol?L-1�������pHת��Ϊ�������������������ˡ�ϴ�ӣ��ڳ����в��ϼ���2.0 mol?L-1���ᣬ������ǡ���ܽ����������Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���������������塣�������Ʊ�����������ȱ�ٵ�ʵ�鲽��Ϊ������Һ��2.0 mol?L-1�����ڲ��Ͻ����µ���pH4����10���ң��� �ڳ����в��ϼ���2.0 mol?L-1���ᣬ������ǡ���ܽ⣻������Ũ����
2AlBr3����5������4���жϷ�Ӧ��ȫ����ֹͣ����������������Ϊ5�Ĺ��л���Һ����ɫ������ƿ6�����ʳ���ɫ������6������5����ܿ�l��4������4ͨ��N2��Ŀ���ǽ�AlBr3��������װ��2�в�������II����������֪����С���ͬѧ�÷�������ȡ�����������ԭ��Ϊ������������������2.0mol?L-1NaOH��Һ��Ӧ����ƫ�����ƣ�����2.0 mol?L-1�������pHת��Ϊ�������������������ˡ�ϴ�ӣ��ڳ����в��ϼ���2.0 mol?L-1���ᣬ������ǡ���ܽ����������Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���������������塣�������Ʊ�����������ȱ�ٵ�ʵ�鲽��Ϊ������Һ��2.0 mol?L-1�����ڲ��Ͻ����µ���pH4����10���ң��� �ڳ����в��ϼ���2.0 mol?L-1���ᣬ������ǡ���ܽ⣻������Ũ����
���㣺�������ʵ��Ʊ�ʵ�飬�����仯��������ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ��һ��ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A�����¡���ѹ�£�16 g O3�к��е���ԭ����Ϊ
B��7.8 g Na2O2��ˮ��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.2 NA
C��0.1 mol Fe��0.1 mol Cl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.3NA
D����״���£�11.2 L H2O�к��е���ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ����ĩ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ,��ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ.��֪�Ƽ�������������ʵ�����Ϊ0.1 mol,ˮ������Ϊ100 g.��
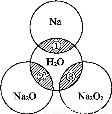
����˵����ȷ����
A��Na2O2����������������Ŀ֮��Ϊ1��1
B����Ӧ������ܲ���0.05 mol O2
C����Ӧ�ٵ����ӷ���ʽΪNa+2H2O==Na++2OH-+H2��
D���١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С��˳��Ϊ��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ����������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪X��Y��Z��W��R��ԭ��������������Ķ���������Ԫ�أ�X�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�YԪ�ص��������������۾���ֵ��ȣ�Z�ĺ˵������Y��2����W���������������ڲ��������3��������˵����ȷ����
A�����뾶��Z2+��W2-��R-
B����Ӧ�⻯����ȶ��ԣ�W��R
C��W��X��W��Z�γɵĻ����ᄃ��������ͬ
D��Y������������Ӧ��ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ����������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ�������
A��HCN�Ľṹʽ��H��C��N
B��HClO�ĵ���ʽΪ��
C��HOCH2COOH������Ľṹ��ʽ��
D��2-�ȼױ��Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�Ͼ��С��γ��и���һģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£������������Ϊ1.0L�ĺ����ܱ������У�����һ������H2��SO2�������з�Ӧ��
3H2(g)+SO2(g)  2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
������� | �¶ȣ��� | ��ʼ���ʵ�����mol | ƽ�����ʵ�����mol | ||
H2 | SO2 | H2 | SO2 | ||
����I | 300 | 0.3 | 0.1 | / | 0.02 |
����II | 300 | 0.6 | 0.2 | / | / |
����III | 240 | 0.3 | 0.1 | / | 0.01 |
����˵����ȷ����
A���÷�Ӧ����ӦΪ���ȷ�Ӧ
B������II�ﵽƽ��ʱSO2��ת���ʱ�����IС
C������III�ﵽƽ���ʱ�������I��
D��240��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.08��104L? mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�Ͼ��С��γ��и���һģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����ָ����Ӧ�����ӷ���ʽ��ȷ����
A����ϡ����ȥ��ͭ�������Cu2(OH)2CO3��Cu2(OH)2CO3+4H+=2Cu2++CO2��+3H2O
B����ϡ����ȥ���Թ��ڱڵ�������Ag+NO3-+2H+=Ag++NO2��+H2O
C����AlCl3��Һ�м��백ˮ��Al(OH)3��Al3++3OH-=Al(OH)3��
D����FeI2��Һ�м������������H2O2��2I-+H2O2+2H+=I2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���Ƹ۵����и���һģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
������C���Ʊ�Һ�����ϵ��м���֮һ��������A��B��һ���������Ƶ�
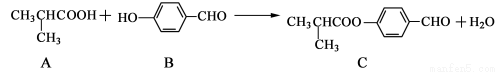
����˵����ȷ����
A��ÿ��A�����к���1������̼ԭ��
B������������KMnO4��Һ����B���Ƿ���ȩ��
C��1molC����������4molH2�����ӳɷ�Ӧ
D��C�ɷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�����и�����һѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�����������˵����ȷ����
A��7.8 g Na2O2�к��е���������ĿΪ0.2 NA
B����״���£�2.24 L CHCl3�ķ�����Ϊ0.1 NA
C��1 L 0.1 mol/L Al2(SO4)3��Һ�У�Al3+����ĿΪ0.2 NA
D��0.1 mol Fe������ϡHNO3��Ӧ��ת�Ƶ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com