
分析 K2Cr2O7+14HCl═2KCl+3Cl2↑+7H2O+2CrCl3反应中,Cr元素化合价降低,被还原,K2Cr2O7是氧化剂,生成CrCl3为还原产物,Cl元素化合价升高,被氧化,HCl是还原剂,生成Cl2为氧化产物,氧化还原反应中氧化剂和还原剂之间得失电子的数目相等,表现为化合价升降总数相等,据此分析解答.
解答 解:(1)K2Cr2O7+14HCl═2KCl+3Cl2↑+7H2O+2CrCl3反应中,Cr元素化合价降低,被还原,K2Cr2O7是氧化剂,生成CrCl3为还原产物,Cl元素化合价升高,被氧化,HCl是还原剂,生成Cl2为氧化产物,又14HCl参与反应,6HCl中Cl元素化合价升高作还原剂,所以氧化剂和还原剂的物质的量之比为1:6,故答案为:Cr;Cl2;CrCl3;1:6;
(2)K2Cr2O7+14HCl═2KCl+3Cl2↑+7H2O+2CrCl3反应中,Cr元素化合价降低,被还原,K2Cr2O7是氧化剂,Cl元素化合价升高,被氧化,HCl是还原剂,转移电子数为6e-,用双线桥标出电子转移的方向和数目可表示为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意从元素化合价的角度判断氧化还原反应的相关概念,注意能熟练用单线桥法标出电子转移的方向和数目.


科目:高中化学 来源: 题型:选择题
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加入催化剂或加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol/(L•s) | B. | v(A2)=0.4mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(B2)=1.0mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的OH-中含有的电子数为0.9NA | |
| B. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| C. | 6.02×1022个 CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28 g N2中所含原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
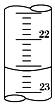 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 由溴丙烷水解制丙醇和由丙烯与水反应制丙醇反应类型相同 | |
| D. | 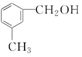 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
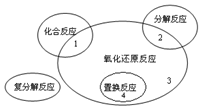 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L一氧化碳中含有的分子数等于0.5NA | |
| B. | 1mol FeCl3制得的氢氧化铁胶体中含胶粒数为NA | |
| C. | 32g臭氧所含电子数目为16NA | |
| D. | 0.5L 2mol/L盐酸中含有的HCl分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com