
【题目】一定温度下的密闭容器中发生反应2SO2 + O2 ![]() 2SO3,下列说法正确的是
2SO3,下列说法正确的是
A. 2 molSO2和1 molO2反应可生成2 molSO3
B. 向上述反应中再加入18O2,达平衡时,18O只存在于SO3中
C. 升高温度,只能加快2SO2+O2![]() 2SO3(g)反应的正反应速率
2SO3(g)反应的正反应速率
D. 选择适宜的催化剂能增大反应速率,提高生产效率
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】I.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
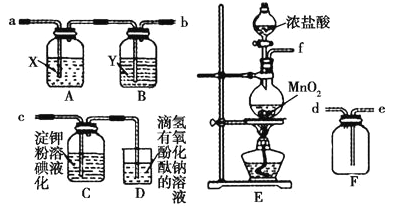
请回答下列问题:
(1)整套实验装置的连接顺序是f接_____接_____接____(填各接口处的字母代号)。
(2)E装置中制取氯气的离子方程式是___________________。
(3)A装置中试剂X是___________________。
(4)C装置中的现象是________,产生此现象的原因是____________(用离子方程式和必要的文字解释)。
II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池选择的电解质溶液是______________(填化学式);
(2)正极电极反应的离子方程式是____________________;
(3)若导线上转移电子1mol,则生成银的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族有机物A(C11H12O2)可用作果味香精,用含碳、氢、氧三种元素的有机物B和C为原料可合成A.请按所给信息及相关要求填空:
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3.有机物B的分子式为 .
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使溴的四氯化碳溶液褪色.C的名称为
(3)已知两个醛分子间能发生如下反应(R、R′表示氢原子或烃基): ![]() 用B和C为原料按如下路线合成A:
用B和C为原料按如下路线合成A:
①上述合成过程中涉及的反应类型有:(填写序号)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
②F的结构简式为: .
③G和B反应生成A的化学方程式: .
(4)F的同分异构体有 多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。同学们对此有下列一些“理解”,你认为其中 不正确的是
A. 纳米级金刚石属于胶体 B. 制造过程中元素种类没有改变
C. CCl4是一种化合物 D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( ) 
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.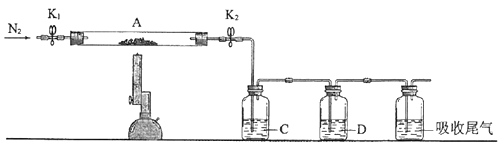
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com