
铜钱在历史上曾经是一种广泛流通的货币。从物理性质和化学性质的角度分析,铜常用于制造货币的说法正确的是
A.铜来源广泛,易于从自然界冶炼得到
B.铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型
C.铜的外观为紫红色,大方美观,易于被人们接受
D.铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O; 2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在反应过程中,溶液的pH不变
C.在反应过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组进行了如下实验探究:将适量1.00 mol·L-1 CuSO4溶液和2.00 mol·L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2.CuSO4]。将9.08 g A隔绝空气在1 000℃左右强热,得到了5.76 g砖红色固体B(铜的+1价氧化物),同时得到的混合气体C;再将5.76 g B溶于过量稀硫酸得到2.56 g另一种红色固体D和蓝色溶液。
(1)实验需用1.00 mol·L-1 CuSO4溶液480ml,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需_________________________;所称取的胆矾固体是____________;;配制溶液浓度会导致所配溶液浓度偏高的是_______________
A.称量质量正确,但胆矾晶体部分失结晶水 B.配制溶液时,定容时仰视容量瓶刻度线
C.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度
D.称量胆矾时把胆矾放在右盘称
(2)B与稀硫酸反应的化学方程式为________________________________________。
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是______________。
(4)气体C的成分:__________________________(SO3和SO2不需填)。
(5)通过计算确定A的组成为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是_____________。
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧,生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是______________________________________。
(3)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为_____________(保留2位小数)。
②若燃烧后气体体积缩小了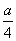 mL,则a与b关系的数学表示式是____________。
mL,则a与b关系的数学表示式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
①合金的性质与其组成金属的性质不完全相同 ②火烧孔雀石[Cu2(OH)2CO3]也属还原法 ③金属冶炼的本质是金属阳离子得到电子变成金属原子 ④工业上金属Mg、Al都是用电解熔融氯化物制得的 ⑤越活泼的金属越难冶炼
A.①②③ B.只有④
C.④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72 L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L。则原合金样品中镁的质量为
A.4.8 g B.6 g
C.9.6 g D.12g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.往澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
B.往碳酸钠溶液中加入二氧化硅:CO +SiO2===SiO
+SiO2===SiO +CO2↑
+CO2↑
C.二氧化硅与烧碱溶液反应:SiO2+2OH-===SiO +H2↑
+H2↑
D.硅酸与烧碱溶液中和:H2SiO3+2OH-===SiO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
ⅰ.高温下用碳还原二氧化硅制得粗硅
ⅱ.粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl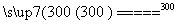 SiHCl3+H2
SiHCl3+H2
ⅲ.SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知:SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第ⅰ步制备粗硅的化学反应方程式为____________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为______________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
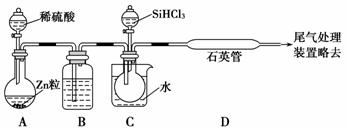
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是_____________________________________,
装置D不能采用普通玻璃管的原因是______ _______________________________________,
_______________________________________,
装置D中发生反应 的化学方程式为_______________________________________________。
的化学方程式为_______________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):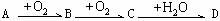 。
。
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,且D为强酸,则A、D分别为(填写化学式)A: ,D: 。
写出A→B转化的化学方程式: 。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。则A为 ,写出A→B转化的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com