
【题目】下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机化合物J 是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。化合物J的一种合成路线如下:

已知:① A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,目峰面积之比为1:2:2:1。
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答下列问题:
(1)A的化学名称是_______,A+D→E的反应类型是_______。
(2)C→D的化学方程式是______________。
(3)化合物G中官能团的名称是______。
(4)鉴定I分子结构中官能团的光谱分析方法是__________。
(5)符合下列条件的E的同分异构体的数目有______种。
①能发生水解反应 ② 苯环上只有两个对位取代基 ③ 与FeCl3溶液发声显色反应
(6)以有机物B为原料,结合题设合成路线,写出制备l,3一丁二醇的转化流程图(无机化合物原料任选)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片与稀硫酸反应制取氢气是,下列的措施中不能使氢气生成速率加快的是( )
A. 滴加少量硫酸铜溶液 B. 不用铁片,改用铁粉
C. 不用稀硫酸,改用98﹪浓硫酸 D. 加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,金属离子(Mn+)浓度的负对数值随溶液pH变化关系如图所示[已知:pM=-lgc(Mn+),且假设c(Mn+)≤10-6mol/L认为该金属离子已沉淀完全]。根据判断下列说法正确的是( )
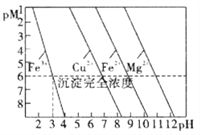
A. 常温下,Ksp[Mg(OH)2]<Ksp[Fe(OH)2]
B. 可以通过调节溶液pH的方法分步沉淀Cu2+和Fe2+
C. 除去Cu2+中少量Fe3+,可控制溶液3≤pH<4
D. pM与Ksp之间的关系式为:pM=lgKsp- nlgc(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是 ( )
A. 目前我国流通的硬币是由合金材料制造的
B. 在钢中加入一定比例的Cr可防锈,不锈钢永远不会生锈
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积可变的密闭容器中发生反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)。
Fe3O4(s)+4H2(g)。
回答下列问题:
(1)增加Fe的量,正反应速率 (填“增大”、“减小”或“不变”,下同)。
(2)将容器的容积缩小一半,正反应速率 ,逆反应速率 。
(3)保持容器的容积不变,充入N2使体系压强增大,正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,正反应速率 ,逆反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所列各物质的用途中,不正确的是( )
A. 硅酸:粘合剂、耐火材料 B. 硅胶:干燥剂、吸附剂、催化剂载体
C. 碳化硅:砂纸、砂轮 D. 分子筛:吸附剂、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol

(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质氧化镁是新型功能复合材料的重要添加剂,可由菱镁矿(含MgCO3、CaCO3、Fe2O3、Al2O3、SiO2)为原料制备,其制备流程如下:

(1)酸溶时,为了提高酸溶速率可采用的措施有______;提高矿物的浸取率可采取的措施有______。(各答一条即可)
(2)浓硫酸与Al2O3反应的化学方程式为___________;滤渣I的主要成分为______和______(填化学式)。
(3)用氨水调节溶液pH =8~9的目的是______,若氨水加的量较多使pH >9,则最终氧化镁的产量会______(填“增大”“不变”或“减小”)。
(4)沉镁时发生反应的离子方程式为________________。
(5)流程中“焙烧”操作若在实验室中进行,样品应放在______中加热(填仪器名称),当______时,说明固体样品已分解完全。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com