
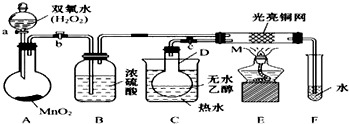
分析 (1)过氧化氢在二氧化锰催化作用下生成水和氧气;浓硫酸具有吸水性,能够干燥氧气;加热乙醇得到乙醇蒸气进入M;
(2)铜丝和氧气反应生成氧化铜,氧化铜和乙醇反应又生成铜;
(3)依据M中发生的反应叙述反应现象,判断铜的作用;
(4)乙醛与新制氢氧化铜发生氧化反应生成乙酸、氧化亚铜和水.
解答 解:(1)A中发生反应:过氧化氢在二氧化锰催化作用下生成水和氧气,化学方程式:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;浓硫酸具有吸水性,所以B的作用干燥氧气;C中热水使D中乙醇变为蒸气进入M中参加反应;
故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;干燥氧气;
(2)铜丝和氧气反应生成氧化铜,氧化铜和乙醇反应又生成铜,反应的方程式:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,M管中铜网黑、红交替出现;催化剂参加反应过程,催化作用需要一定的温度;
故答案为:M管中铜网黑、红交替出现;参加;温度;
(4)乙醛与新制氢氧化铜发生氧化反应生成乙酸、氧化亚铜和水,化学方程式:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
点评 本题考查了乙醇的催化氧化,明确过氧化氢、乙醇的性质是解题关键,注意催化剂在反应中作用,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>Y | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均可与Mg形成离子化合物 | D. | 氧化物对应水化物的酸性:W>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
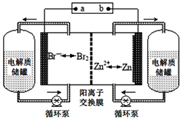 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| C. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)═2CO(g);△H2.则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com