
分析 (1)依据配制溶液体积选择容量瓶规格,依据m=CVM计算溶质的质量;
(2)依据配制一定物质的量一般步骤选择需要仪器;
(3)容量瓶带有活塞,为防止漏水,使用前应检查是否漏水;
(4)溶解过程需要用玻璃棒搅拌;移液过程需要用玻璃棒引流;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)凡是不当操作导致实验失败且无法补救的应重新配制,能够补救的可以按照正确操作补救.
解答 解:(1)配制1mol•L-1的NaOH溶液450mL,应选择500mL容量瓶,实际配制500mL容量瓶,需要溶质的质量m=1mol/L×0.5L×40g/mol=20.0g;
故答案为:20.0;
(2)配制溶液的操作步骤:首先计算出需要的溶质的质量,然后天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.在此过程中用到的仪器有:天平、量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器:500ml 容量瓶、胶头滴管;
故答案为:500ml 容量瓶;胶头滴管;
(3)容量瓶带有活塞,为防止漏水,使用前应检查是否漏水;
故答案为:查漏;
(4)溶解过程需要用玻璃棒搅拌;移液过程需要用玻璃棒引流;
故答案为:搅拌;引流;
(5)A.容量瓶实验前用蒸馏水洗干净,但未烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故A不选;
B.天平砝码生锈,导致称取的溶质的质量偏大,溶液浓度偏高,故B选;
C配制过程中遗漏了洗涤步骤,导致溶质的物质的量偏小,溶液浓度偏低,故C不选;
D未冷却到室温就注入容量瓶,冷却后溶液体积偏小,溶液浓度偏高,故D选;
E加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故E不选;
F定容观察液面时俯视,导致溶液体积偏小,溶液浓度偏高,故F选;
故选:BDF;
(6)未冷却到室温就注入容量瓶,冷却后液面下降,实验失败,但是可以补救:用胶头滴管逐滴滴加蒸馏水到凹液面最低处有刻度线相切;
故答案为:用胶头滴管逐滴滴加蒸馏水到凹液面最低处有刻度线相切.
点评 本题考查了物质的量浓度的有关计算及配制一定物质的量浓度的溶液误差分析,难度不大,明配制原理及操作步骤是解题关键,要注意配制一定物质的量浓度溶液的误差分析,根据验操作对c=$\frac{n}{V}$产生的影响判断,分析变化的物理量,从而确定浓度的变化.


科目:高中化学 来源: 题型:解答题
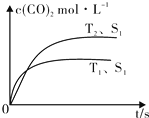 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com