
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
分析 C5H10O2的有机物在碱性条件下水解,产物之一可以在铜的催化作用下氧化为醛,则该产物为含-CH2OH的醇,结合酯的生成及醇的结构判断.
解答 解:分子式为C5H10O2的有机物,有果香味,不能使紫色石蕊试液变红,则不属于羧酸类,属于饱和一元酯,
若为甲酸和丁醇酯化,丁醇有4种,其中能氧化为醛的醇有:1-丁醇,2-甲基-1-丙醇,甲酸只有一种,符合条件的酯有2种;
若为乙酸和丙醇酯化,丙醇有2种,其中能氧化为醛的醇有:1-丙醇,乙酸只有一种,符合条件的酯有1种;
若为丙酸和乙醇酯化,乙醇只有1种能氧化互为乙醛,丙酸有1种,符合条件的酯有1种;
若为丁酸和甲醇酯化,甲醇只有1种,能氧化为甲醛,丁酸有2种,符合条件的酯有2种;
故可能的结构共有6种,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应、同分异构体判断为解答的关键,侧重分析与应用能力的考查,注意醇催化氧化的结构特点,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验时,不慎把浓硫酸洒在皮肤上,正确的处理方法是( )
A. 用水冲洗,再涂上硼酸溶液
B. 用氢氧化钠溶液中和,再用水冲洗
C. 用布擦去硫酸后,用稀氢氧化钠溶液冲洗
D. 用大量清水冲洗,再用3%~5%的碳酸氢钠溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
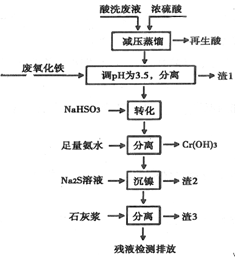
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出化合物EDA的电子式
;写出化合物EDA的电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com