
| A、25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同 |
| B、25℃时,Ksp(A)>Ksp(B),说明化合物A的溶解度比化合物B的大 |
| C、常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-) |
| D、在(NH4)2SO4溶液中c(NH4+):c (SO42-)=2:1 |


科目:高中化学 来源: 题型:
| A、1molNa被完全氧化为Na2O2,失去的电子数为2NA |
| B、常温常压下,16gO3气体含有氧原子数为NA |
| C、常温常压下,22.4LCO2 含有分子数为NA |
| D、18g D2O所含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
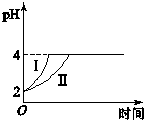 在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )
在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )| A、曲线Ⅰ表示盐酸的pH变化 |
| B、曲线Ⅱ表示盐酸的pH变化 |
| C、在相同条件下,两溶液生成的气体体积相等 |
| D、醋酸溶液中加入锌的质量比盐酸溶液中多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2SO2+O2
| ||||
| B、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol | ||||
| C、C(s)+O2(g)=CO2(g)△H=+393.5kJ/mol | ||||
D、H2O(l)═H2(g)↑+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH) |
| A、中性溶液的AG=0 |
| B、常温下0.lmol/L氢氧化钠溶液AG=12 |
| C、酸性溶液的AG<0 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MnO2+4HCl(浓)
| ||||
| B、3Br2+6KOH═5KBr+KBrO3+3H2O | ||||
C、2KNO3
| ||||
D、NH4NO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L氧气中一定含有6.02×1023个氧分子 |
| B、18g水在标准状况下的体积是22.4L |
| C、标准状况下,20mL NH3与60mL O2所含的分子数之比为1:3 |
| D、金属元素只能存在于阳离子中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com