

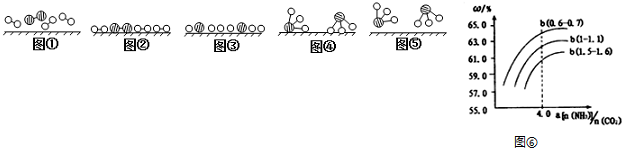
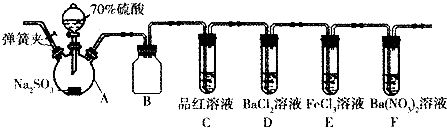
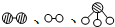 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.分析 (1)B为氧化炉,在氧化炉中氨气与氧气催化氧化生成一氧化氮和水;
(2)按照气体分子向催化剂表面靠近、被吸附、分子分解成原子、氮原子和氢原子结合生成氨气、氨气分子离开催化剂的顺序解答;
(3)①由图可知,水碳比[n(H2O):n(CO2)]b的值越小,则CO2转化率ω越大;
②a控制在4.0时,CO2转化率ω已经达到较高的值,而继续提高氨碳比[n(NH3):n(CO2)],CO2转化率ω无明显提高;
(4)合成氨的反应属于放热反应,热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,NO能被氧气氧化为二氧化氮;
(5)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(6)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数.
解答 解:(1)在上述工业制硝酸的生产中,B设备是进行氨的催化氧化反应,在氧化炉中进行;发生反应的方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
故答案为:氧化炉;4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(2)在上述工业生产中,N2与H2合成NH3的催化剂是铁砂网氮;氮气气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,图④表示氮原子与氢原子重新结合成氨分子,图⑤生成的氨气离开催化剂表面,
故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(3)①由图可知,水碳比[n(H2O):n(CO2)]b的值越小,则CO2转化率ω越大,故b应控制在0.6~0.7,故选C;
②a控制在4.0时,CO2转化率ω已经达到较高的值,而继续提高氨碳比[n(NH3):n(CO2)],CO2转化率ω无明显提高,故控制在4.0,故答案为:a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,CO2转化率无明显增大;
(4)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:利用余热,节约能源;可使NO循环利用,全部转化成HNO3;
(5)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{△}$7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,故答案为:NH3还原法;
(6)根据氮原子守恒可知,NH3~NO~HNO3,
则1mol氨气可得到硝酸的物质的量为:1mol×96%×92%=0.8832mol,
根据HNO3+NH3═NH4NO3可知反应消耗的氨气的物质的量为:0.8832mol,
氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:$\frac{1mol}{1mol+0.8832mol}$×100%≈53.1%,
故答案为:53.1.
点评 本题以硝酸的工业制备为背景,综合考查对化学反应中化学键变化、转化率计算等考点以及对图形的观察能力、推理能力,题目难度中等,注意掌握工业制取硝酸的反应原理.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
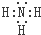 ;
;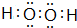 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
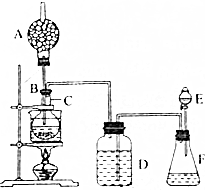
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
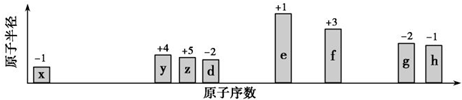
| A. | 元素W与氢形成原子比为1:1的化合物有多种 | |
| B. | 元素X的单质能与水、无水乙醇反应 | |
| C. | 离子Y3+与Z-的最外层电子数和电子层数都不相同 | |
| D. | 元素W与元素Z可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
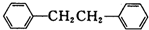 )是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: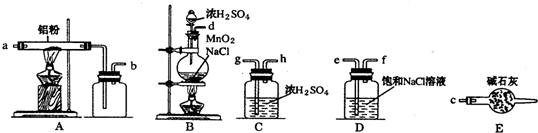
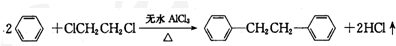
| 名称 | 相对分子质量 | 密度/(g•cm-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g Fe与稀HNO3完全反应时一定转移3NA个电子 | |
| B. | 标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5NA | |
| C. | 常温常压下,0.1NA个Al与足量氢氧化钠溶液反应生成3.36 LH2 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
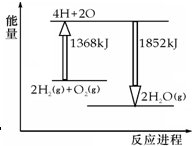
| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(l),放出热量大于484kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
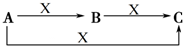 A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:
A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com