
������ͭ����Һ�д�������ƽ�⣺Cu(OH)2(s)![]() Cu2+(aq)��2OH��(aq)����������Ksp��
Cu2+(aq)��2OH��(aq)����������Ksp��
(1)ij����ͭ��Һ��
c(Cu2+)��0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������ҺpHʹ֮����________��(2)Ҫʹ0.2 mol/L����ͭ��Һ��
Cu2+������Ϊ��ȫ(ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ����ΪCu2+������Ϊ��ȫ)����Ӧ����Һ���������������Һʹ��ҺpHΪ________�� ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��6�֣�������ͭ����Һ�д�������ƽ�⣺Cu��OH��2 ��s��Cu2����aq����2OH����aq������������Ksp��c��Cu2���� �� c2��OH������2��10��20mol2��L��2��
��1��ij����ͭ��Һ��c��Cu2������0.02mol/L����Ҫ����Cu��OH��2������Ӧ������ҺpHʹ֮������������������
��2��Ҫʹ0.2mol/L����ͭ��Һ��Cu2��������Ϊ��ȫ��ʹCu2��Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һʹ��ҺpHΪ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��������ͭ����Һ�д�������ƽ�⣺Cu��OH��2 ��s��Cu2����aq����2OH����aq������������Ksp��
![]() ��
��![]() ��
��
��ij����ͭ��Һ��Cu2��Ũ��0.02mol/L����Ҫ����Cu��OH��2������Ӧ������ҺpHʹ֮������������������
��Ҫʹ0.2mol/L����ͭ��Һ��Cu2��������Ϊ��ȫ��ʹCu2��Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һ��ʹ��Һ��OH��Ũ��Ϊ��������������
��2���ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬ����װ����ƿ�У��������̪Ϊָʾ����NaOH��Һװ�� �����������ƣ��С���ɲⶨ���ƫ�ߵ�ԭ������� ��
A. δ�ñ�Һ��ϴ����װ���Һ
B. �ζ�ǰ����ʱ���ӣ��ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
C. ʢװδ֪Һ����ƿ�ô���Һ��ϴ
D. �ζ������У���ƿ����������Һ����
E. �յ�ʱ����Һ��dz��ɫ���Ұ������û����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�츣��ʡ�߶���ѧ�ڵ�һѧ�ο��Ի�ѧ�Ծ� ���ͣ������
(6��) ������ͭ����Һ�д�������ƽ�⣺
Cu��OH��2 ��s��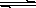 Cu2����aq����2OH����aq������������Ksp��2��10��20��
Cu2����aq����2OH����aq������������Ksp��2��10��20��
��1��ij����ͭ��Һ��c��Cu2������0.02mol/L����Ҫ����Cu��OH��2������Ӧ������ҺpH������������������
��2����ȥCuCl2��Һ��������Fe2+����������������̽��У�
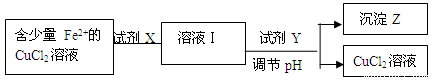
��֪Fe2+ ��Cu2+ ��Fe3+ �������ӿ�ʼ��������ȫ����ʱ��ҺpHֵ���£�
|
���� ���� |
pH |
|
|
��ʼ���� |
��ȫ���� |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
�������������ʺ���Ϊ�Լ�X����
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
�ڼ����Y�����ڵ�pH��Χ��
A.CuCO3 3.7��4.3 B.CuO 3.7��6.4
C.NaOH 3.7��4.2 D.NH3��H2O 3.7��4.0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com