
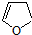
 ,顺丁烯二酸酐
,顺丁烯二酸酐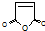 等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下:
等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下: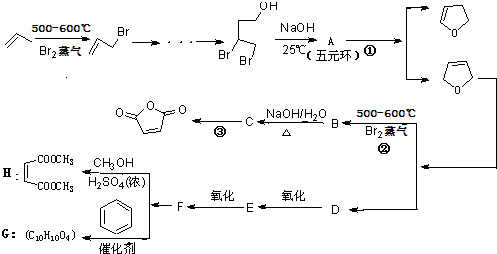
 .D的结构简式HOCH2CH=CHCH2OH
.D的结构简式HOCH2CH=CHCH2OH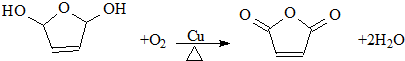 .
.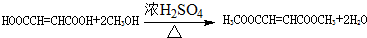 .
. 、
、 .
.分析 根据题中各物质转化关系,比较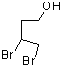 和
和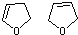 的结构可知A为
的结构可知A为 ,A在氢氧化钠醇溶液中加热发生消去反应得
,A在氢氧化钠醇溶液中加热发生消去反应得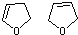 ,
,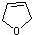 与溴蒸汽发生取代反应生成B为
与溴蒸汽发生取代反应生成B为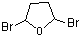 ,B在碱性条件下发生水解反应生成C为
,B在碱性条件下发生水解反应生成C为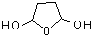 ,C再发生氧化反应得
,C再发生氧化反应得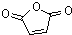 ,D能发生两步氧化,结合H的结构可推知,
,D能发生两步氧化,结合H的结构可推知, 发生水解反应生成D为HOCH2CH=CHCH2OH,D发生氧化反应得E为OHCCH=CHCHO,E发生氧化得F为HOOCCH=CHCOOH,F与甲醇发生酯化反应得H,据此答题;
发生水解反应生成D为HOCH2CH=CHCH2OH,D发生氧化反应得E为OHCCH=CHCHO,E发生氧化得F为HOOCCH=CHCOOH,F与甲醇发生酯化反应得H,据此答题;
解答 解:根据题中各物质转化关系,比较 和
和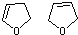 的结构可知A为
的结构可知A为 ,A在氢氧化钠醇溶液中加热发生消去反应得
,A在氢氧化钠醇溶液中加热发生消去反应得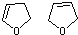 ,
, 与溴蒸汽发生取代反应生成B为
与溴蒸汽发生取代反应生成B为 ,B在碱性条件下发生水解反应生成C为
,B在碱性条件下发生水解反应生成C为 ,C再发生氧化反应得
,C再发生氧化反应得 ,D能发生两步氧化,结合H的结构可推知,
,D能发生两步氧化,结合H的结构可推知, 发生水解反应生成D为HOCH2CH=CHCH2OH,D发生氧化反应得E为OHCCH=CHCHO,E发生氧化得F为HOOCCH=CHCOOH,F与甲醇发生酯化反应得H,
发生水解反应生成D为HOCH2CH=CHCH2OH,D发生氧化反应得E为OHCCH=CHCHO,E发生氧化得F为HOOCCH=CHCOOH,F与甲醇发生酯化反应得H,
(1)根据上面的分析可知,AA为 ,D为HOCH2CH=CHCH2OH,
,D为HOCH2CH=CHCH2OH,
故答案为: ;HOCH2CH=CHCH2OH;
;HOCH2CH=CHCH2OH;
(2)反应①的反应条件为氢氧化钠醇、加热,反应②的反应类型是取代反应,
故答案为:氢氧化钠醇、加热;取代反应;
(3)反应③的化学方程式为 ,F→H的化学方程式为
,F→H的化学方程式为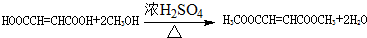 ,
,
故答案为: ;
;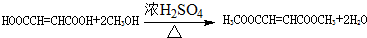 ;
;
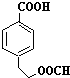
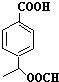
(4)根据G的分子式,结合下列条件①含有苯环,苯环上有两个取代基,且苯环上一氯代物只有两种,说明两个取代基处于对位,②能与NaHCO3反应产生CO2气体,说明有羧基,③能发生水解反应,且其中一种水解产物能发生银镜反应,说明有甲酸酯,则G的同分异构体为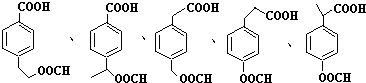 ,
,
故答案为: (其中两种).
(其中两种).
点评 本题考查有机物的推断及有机物的合成,充分利用有机物的结构、给予的信息进行分析解答,熟练掌握官能团性质及转化,难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
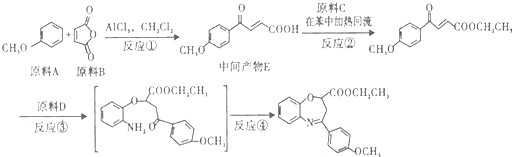
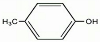 (写出其结构简式).
(写出其结构简式).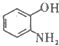 .
.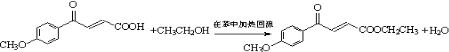 .
.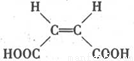 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q: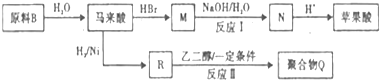
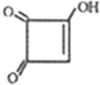 .
.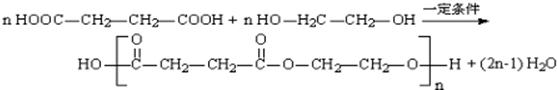 .
.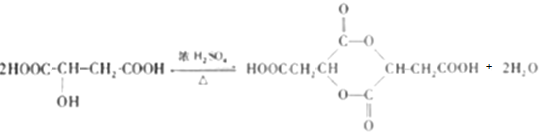 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
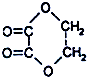 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.| A. | ①②⑤ | B. | ①②⑦ | C. | ②③⑧ | D. | ④⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| B. | pH=2的某酸溶液与pH=12某碱溶液等体积混合 | |
| C. | pH=2的盐酸pH=12的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
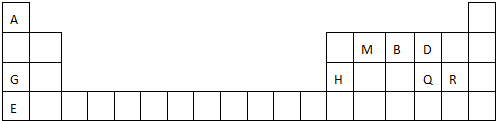
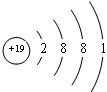
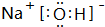 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石与碳纳米管互为同分异构体 | B. | N3与N2互为同素异形体 | ||
| C. | 14C的质量数为14 | D. | C原子半径比N原子半径小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com