解答:解:(1)分析本题的实验装置可知,样品铝碳酸镁片在加热条件下分解生成铝和镁的氧化物、CO
2、H
2O,装置C中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量,所以装置C中是吸收水蒸气,利用无水CaCl
2或P
2O
5 可以吸收,装置D是吸收二氧化碳气体的装置,可以利用碱石灰吸收二氧化碳气体,
故答案为:无水CaCl
2或P
2O
5; 碱石灰或NaOH固体;
(2)实验开始前先通入一段时间空气,气目的是赶净装置B中的二氧化碳和水蒸气,确保CD两装置吸收的水蒸气、二氧化碳全部是样品分解生成的;所以通入的空气必须先除去空气中的水和二氧化碳A装置中应放入碱石灰或固体氢氧化钠,实验开始前先通入一段时间空气,其目的是排除装置B中的CO
2、H
2O,其操作方法是;关闭弹簧夹b,打开弹簧夹a;当B处的酒精灯点燃后以及反应结束后一段时间内仍然要通入空气的目的是排出固体分解产生的CO
2、H
2O,使其被充分吸收,
故答案为:排除装置B中的CO
2、H
2O;关闭弹簧夹b,打开弹簧夹a; 排出固体分解产生的CO
2、H
2O,使其被充分吸收;
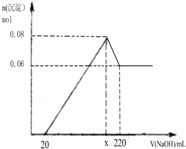
(3)图象分析沉淀0.06mol为Mg(OH)
2,Al(OH)
3物质的量为0.08mol-0.06mol=0.02mol,溶解0.02molAl(OH)
3需要1mol/L的NaOH溶液可以利用反应Al(OH)
3+OH
-=Al(OH)
4-,需要1mol/L氢氧化钠溶液体积为20ml,则x=220ml-20ml=200ml,
故答案为:200;
(4)图象中可以分析得到样品中含Al
3+0.02mol,Mg
2+0.06mol,取mg该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g为水,物质的量
=0.12mol,装置D增重0.44g为CO
2,物质的量为0.01mol;反应中生成水0.12mol,生成二氧化碳0.01mol,Al
3+0.02mol,Mg
2+0.06mol,n(Al
3+):n(Mg
2+):n(CO
32-)=0.02:0.06:0.01=2:6:1,依据元素化合价代数和为0计算氢氧根离子数,2×(+3)+6×(+2)+1×(-2)+氢氧根离子数×(-1)=0,氢氧根离子数=16,所以含有结晶水为4个,据此推算样品的化学式Al
2Mg
6(OH)
16CO
3?4H
2O,
故答案为:Al
2Mg
6(OH)
16CO
3?4H
2O;
(5)胃酸主要成分是盐酸,和该药反应生成的二氧化碳容易使胃壁穿孔,故答案为:因为胃酸和该药作用产生CO
2会刺激胃粘膜,导致胃穿孔;
(6)不需要做实验一,只需要在实验二的基础上再得知两个数据就可以求出铝碳酸镁的化学式,实验二已经知道铝离子、镁离子物质的量,只需要测定二氧化碳物质的量和主要成分的含量既可以计算得到化学式,
故答案为:产生CO
2的物质的量; 药片中主要成份的含量.