
 2NH3 △H<0,达到平衡后,为使H2的转化率增大,下列说法正确的是( )
2NH3 △H<0,达到平衡后,为使H2的转化率增大,下列说法正确的是( )| A.升高温度,降低压强,增加氮气 |
| B.降低温度,增大压强,加入催化剂 |
| C.升高温度,增大压强,增加氮气 |
| D.降低温度,增大压强,分离部分氨 |
科目:高中化学 来源:不详 题型:单选题
 AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是
AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是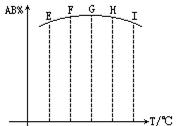
| A.反应是放热反应 |
| B.E、F二点尚未达到平衡状态 |
| C.H、I二点尚未达到平衡状态 |
| D.G、H、I三点功能已达平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
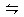 2NH3(g)。
2NH3(g)。| A.大于6mol | B.等于6mol |
| C.小于6mol | D.可能大于、小于或等于6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.①③②④ | C.④③②① | D.②③④① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
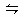 2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )| A.降温 | B.升温 | C.减压 | D.增压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.N2(g)+3H2(g)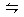 2NH3(g);ΔH<0 2NH3(g);ΔH<0 |
B.N2(g)+O2(g)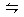 2NO(g);ΔH<0 2NO(g);ΔH<0 |
C.C(s)+H2O(g)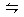 CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
D.2SO2(g)+O2(g)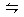 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 bZ(g)
bZ(g)| A.a=1,b="1" | B.a=2,b="1" |
| C.a=2,b="2" | D.a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com