
| A. | F-H | B. | Cl-H | C. | Br-H | D. | I-H |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
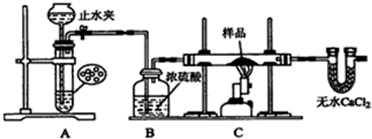
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
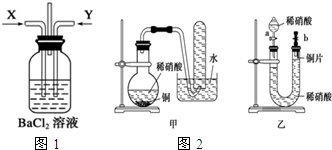 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
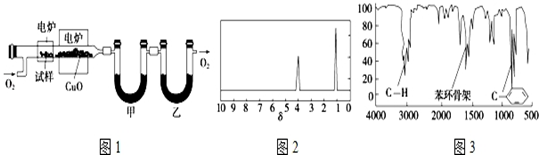
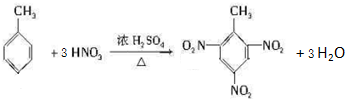 .
.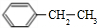 、
、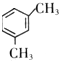 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
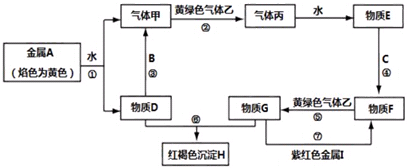
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能直接转变为电能的装置 | |
| B. | 原电池负极发生的电极反应是还原反应 | |
| C. | 原电池在工作时其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com