
| A. pH=0的溶液中:Al3+、NH4+.Ca2+、ClO- |
| B.含有大量HCO3-的溶液:NH4+.Ca2+、Mg2+、I- |
| C.加入铝粉能产生H2的溶液:NH4+.Fe2+、SO42-.NO3- |
| D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42- |
科目:高中化学 来源:不详 题型:单选题
A.强酸性溶液中:Mg2+、K+、SO42-、NO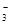 |
B.强碱性溶液中:Na+、Cu2+、HCO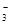 、NO 、NO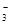 |
| C.0.1mol·L-1AgNO3溶液中:H+、K+、SO42-、Cl- |
| D.0.1mol·L-1Ba(NO3)2溶液:Mg2+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL溶液中含0.01mol CO32- | B.Cl-一定存在 |
| C.K+一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液:Fe3+、SO2—4、HCO—3 |
| B.Na2SiO3溶液:S2—、SO2—3、Cl— |
| C.乙酸溶液:NH+4、NO—3、CO2—3 |
| D.酸性高锰酸钾溶液:Al3+、I—、SO2—4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溶液中存在电离平衡:(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
| B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 |
| C.加水稀释,溶液中所有离子的浓度均减小 |
| D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42- |
| B.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO3- |
| C.NaHCI3溶液中:C6H5O-、CO32-、Br-、K+ |
| D.c(Ca2+)=0.1mol·L-1的溶液中:NH4+、SiO32-、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.发生析氢腐蚀的溶液中:NH4+、Ba2+、AlO2-、Cl- |
| B.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| D.甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com