
A��pH =8��3��NaHCO3��Һ��c�� Na+����c�� HC ��>c��C ��>c��C  ����c�� H2CO3�� ����c�� H2CO3�� |
| B���к�ͬŨ��ͬ���������ʹ��ᣬ���ĵ�NaOH�����ʵ�������ͬ |
| C����һ��Ũ�ȵ�NaOH��Һ�ζ�����ᣬ��pH =6ʱ����Һ��c��F������c��Na+��=9��9��l0��7 mol/L |
| D����NaOH��Һ�ζ�HCI��CH3COOH�Ļ����Һ������ʱ����Һ�е��ᱻ��ȫ�к� |
 ����A����ȷ��B��ͬŨ��ͬ���������ʹ��������ʵ����ʵ�����ͬ���к�ͬŨ��ͬ���������ʹ��ᣬ���ĵ�NaOH�����ʵ�����ͬ��B����ȷ��C���ɵ���غ㣬c��F������c��Na+��=c��H�� ����c��OH�D��=10�D6�D10�D8=9��9��l0��7 mol/L,C��ȷ��D�����������ᣬ�к�������ʱ����Һ���������D����ȷ��ѡC��
����A����ȷ��B��ͬŨ��ͬ���������ʹ��������ʵ����ʵ�����ͬ���к�ͬŨ��ͬ���������ʹ��ᣬ���ĵ�NaOH�����ʵ�����ͬ��B����ȷ��C���ɵ���غ㣬c��F������c��Na+��=c��H�� ����c��OH�D��=10�D6�D10�D8=9��9��l0��7 mol/L,C��ȷ��D�����������ᣬ�к�������ʱ����Һ���������D����ȷ��ѡC��

 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ȼ�����ǽ�ˮ��Ϊ�͵�����ȼ�� |
| B�������Ǿ�����ֵ�ߡ�����Ⱦ���ŵ��ȼ�� |
| C���Ҵ��DZ���������������������ȼ�� |
| D��ʯ�ͺ�ú�ǹ�������ʹ�õĿ������Ļ�ʯȼ��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��ˮ���ӵı���ģ���ǣ� |
| B��100��ʱ����ˮ��pH=7 |
| C����Ȼˮ�к���2H2O����ˮ�� |
| D��1H2O��2H2O�������ʡ���ѧ������ȫ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
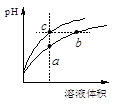
| A��a��c������Һ�ĵ���������ͬ |
| B��b����Һ��c(H+)+c(NH3��H2O)=c(OH��) |
| C��a��b��c������Һˮ�ĵ���̶�a��b��c |
| D��������b��c����Һ��Ӧ�����ĵ�����NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
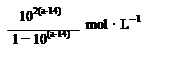
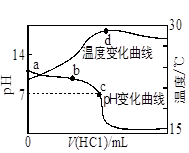
| A�������£�a��İ�ˮ���볣��Ϊ |
| B�����˰�ˮϡ�ͣ���Һ�ĵ����������� |
| C��c��ʱ�����������V(HCl)��20mL |
| D��a��d�������Һ��ˮ�����ӻ�Kw(a)��Kw(d) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������ƵĻ����Һ�У�c(CH3COO��)+ c(OH��) = c(Na+) + c(H+) |
| B��1 mol��L��1Na2CO3��Һ�У�c(OH��) = c((H+) + c(HCO3��) + c(H2CO3) |
| C��0.1 mol��L��1���������Һ�У�c(SO42��) >c(NH4+)>c(H+)> c(OH��) |
| D����1molKCl��1molNaHS����ˮ���1L�����Һ�У� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
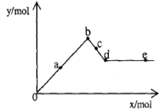
| A��aʱ����������Ϊ3.495 g |
| B��bʱ���������ʵ���Ϊ0.05 mol |
| C��cʱ��Һ��Ba2+���ӵ����ʵ���Ϊ0.005 mol |
| D��eʱ��Һ��AlO2�������ʵ���Ϊ0.01 mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com