
| A.阳极100g,阴极128g | B.阳极93.6g,阴极121.6g |
| C.阳极91.0g,阴极119.0g | D.阳极86.0g,阴极114.0g |
科目:高中化学 来源:不详 题型:问答题
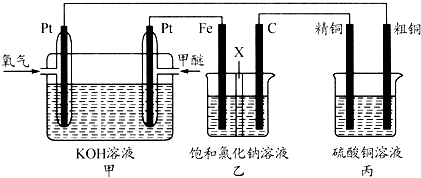
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 |
| B.Cu的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜 |
| C.Fe通常采用热还原法冶炼,加入石灰石的目的是除去过量的碳 |
| D.由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
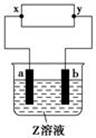
| | a极板 | b极板 | x电极 | Z溶液 |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
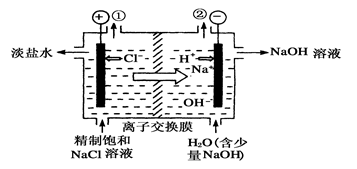
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.装置中发生反应的离子方程式为:2Cl-+2H+通电Cl2↑+H2↑ |
| C.该装置是将电能转化为化学能 |
| D.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
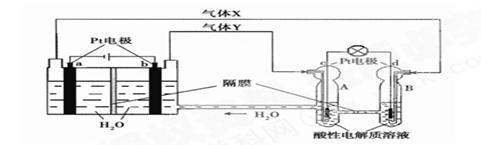
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com