
(16分)以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g)+H2O?△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。

a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(16分)(1)-45.5 kJ·mol-1(2分)(2)>;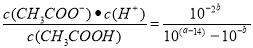 /mol
/mol
(3)3OH-+2CO2 == CO32-+HCO3-+H2O (2分) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(3分)
(4)2NH3+6OH--6e- =N2+6H2O(2分);2.7×10-13(2分);>(2分)
【解析】
试题分析:(1)①-②-③,整理可得C2H4 (g)+2H2O(g)= CH3CH2OH(g) △H=-45.5 kJ·mol-1;(2)在25℃下,将pH=a的氢氧化钠溶液,c(OH-)=10(a-14)mol/L与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则n(NaOH) =n(CH3COOH)。由于醋酸是弱酸,部分电离在溶液中存在电离平衡,所以c(CH3COOH)>c(H+)=10-bmol/L.如果醋酸是强酸,则c(OH-)=10(a-14)= 10-bmol/L= c(H+);a+b=14,但是醋酸是弱酸,酸的浓度大于氢离子的浓度,所以a+b>14;该温度下醋酸的电离常数K=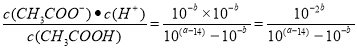 。(3)n(NaOH)=0.1L×3mol/L=0.3mol,n(CO2)= 4.48L÷22.4L/mol=0.2mol,则反应方程式是:3OH-+2CO2 == CO32-+HCO3-+H2O反应后得到的溶液是Na2CO3和NaHCO3按照1:1混合的混合溶液。由于CO32-的水解和HCO3-的水解,消耗水电离产生的H+,使溶液显碱性,c(OH-)>c(H+)而且水解程度CO32-> HCO3-,所以c(HCO3-)>c(CO32-),但是盐水解的程度是微弱的,所以c(CO32-)>c(OH-),根据物料守恒可知c(Na+)的浓度最大。因此所得溶液中离子浓度大小排列顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。产生的X气体可直接排放到大气中。在a电极氨气被氧化为N2排到大气中,该电极反应式为2NH3+6OH--6e- =N2+6H2O;2.7×10-13(2分);>(2分);T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,
。(3)n(NaOH)=0.1L×3mol/L=0.3mol,n(CO2)= 4.48L÷22.4L/mol=0.2mol,则反应方程式是:3OH-+2CO2 == CO32-+HCO3-+H2O反应后得到的溶液是Na2CO3和NaHCO3按照1:1混合的混合溶液。由于CO32-的水解和HCO3-的水解,消耗水电离产生的H+,使溶液显碱性,c(OH-)>c(H+)而且水解程度CO32-> HCO3-,所以c(HCO3-)>c(CO32-),但是盐水解的程度是微弱的,所以c(CO32-)>c(OH-),根据物料守恒可知c(Na+)的浓度最大。因此所得溶液中离子浓度大小排列顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。产生的X气体可直接排放到大气中。在a电极氨气被氧化为N2排到大气中,该电极反应式为2NH3+6OH--6e- =N2+6H2O;2.7×10-13(2分);>(2分);T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5, ’NH4+的水解平衡常数为1.5×10-8,
’NH4+的水解平衡常数为1.5×10-8, 
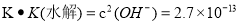 由于水电离产生的c(H+)=c(OH-),所以在该温度下水的离子积常数为Kw=2.7×10-13,由于在该温度下的水的离子积常数大于1.0×10-14,说明水的电离受到了促进,根据平衡移动原理:升高温度,电离平衡向水电离的方向移动,所以温度T>25℃。
由于水电离产生的c(H+)=c(OH-),所以在该温度下水的离子积常数为Kw=2.7×10-13,由于在该温度下的水的离子积常数大于1.0×10-14,说明水的电离受到了促进,根据平衡移动原理:升高温度,电离平衡向水电离的方向移动,所以温度T>25℃。
考点:考查热化学方程式的书写、酸碱混合溶液的pH的计算、离子浓度大小比较、水的电离平衡常数的计算及影响因素的知识。


科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
下列微粒既有氧化性又有还原性的是
A.H+ B.Cu2+ C.Fe2+ D.Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
物质间常常相互联系、互相影响着,微粒也不例外。下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、C1O-、I-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、C1-、NH4+
C.常温下水电离出的 的溶液中:Na+、Cl-、S2-、SO32-
的溶液中:Na+、Cl-、S2-、SO32-
D.无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法不正确的是
A.铵态氮肥不能与草木灰共同施用
B.金属冶炼大多利用氧化还原反应原理
C.聚酯纤维和光导纤维都属于新型无机非金属材料
D.江河入海口形成的沙洲和卤水点豆腐都体现了胶体聚沉的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是

A.X元素最高价氧化物对应水化物的酸性弱于Y元素的
B.Y元素气态氢化物的稳定性大于Z元素的
C.M和Y两种元素,可以形成电子层结构相同的两种简单离子
D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:填空题
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(5)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
根据下列实验现象,所得结论错误的是

实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com