
| A. | 溴苯中的溴(氢氧化钠溶液,蒸馏) | |
| B. | 乙酸乙酯中少量的乙醇和乙酸(氢氧化钠溶液,分液) | |
| C. | 乙烷中的乙烯(酸性KMnO4溶液,洗气) | |
| D. | 乙醇中的水 (CaO,蒸馏) |
分析 A.溴与NaOH反应后,与溴苯分层;
B.乙酸乙酯与NaOH反应;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.CaO与水反应后,增大与乙醇的沸点差异.
解答 解:A.溴与NaOH反应后,与溴苯分层,然后分液可分离,故A错误;
B.乙酸乙酯与NaOH反应,应选饱和碳酸钠溶液、分液,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气,故C错误;
D.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 大力开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| B. | “地沟油”禁止食用,但可以用来制造肥皂或生物柴油 | |
| C. | 聚乙烯塑料老化是因为发生了加成反应 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.23 g | B. | 0.46 g | C. | 0.69 g | D. | 0.92 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )
NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl、HNO3和Na2CO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | S | H2 |
| ④ | FeCl3溶液 | Fe | 稀硫酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
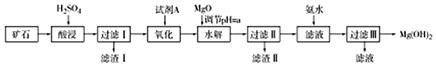
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为2mol | |
| C. | 反应到达平衡时,放出的热量是2a KJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol/L的NH4NO3溶液中氢原子总数为0.4NA | |
| B. | 0.5 mol 甲基中电子数为5NA | |
| C. | 在反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑中,每生成3 mol CO2转移的电子数为5NA | |
| D. | 常温常压下,22.4 L N2H4中N-H键数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com