
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |



 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| O | 2- 7 |
| �������↑ʼ����ʱ��pH | �������↑ʼ������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |

| O | 2- 7 |
| O | 2- 7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | Fe2+ | 7.0 | 9.0 | Fe3+ | 1.9 | 3.2 | Cr3+ | 6.0 | 8.0 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ�����и�����ѧ����ĩ���Խ�ѧ������⻯ѧ�Ծ� ���ͣ����
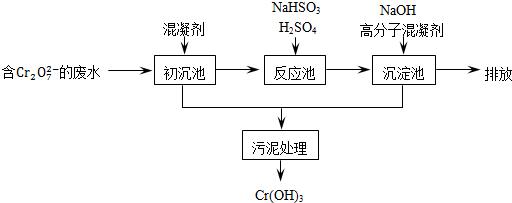
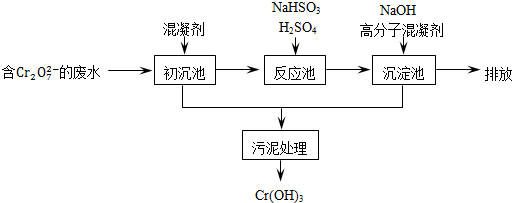
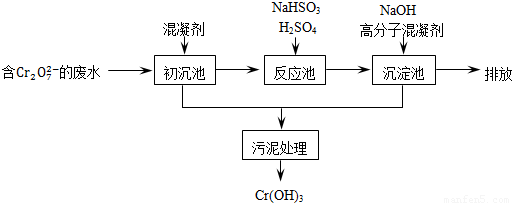
��11�֣������ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O2-7ת��ΪCr��OH��3������ȥ����֪��

��1��ij������ˮ��������Ҫ������ͼ��ʾ��

�ٳ����м���Ļ�������K2SO4��Al2��SO4��3��24H2O�������ӷ���ʽ��ʾ�䷴Ӧԭ��
��
�ڷ�Ӧ���з�����Ҫ��Ӧ�����ӷ���ʽ��Cr2O2��7+3HSO��3+5H+===2Cr3++3SO2��4+H2O�����ݡ����������͡��кͷ�����ԭ������������м���NaOH��Һ���˹����з�����Ҫ��Ӧ�����ӷ���ʽ�� �� ��֤��Cr3+������ȫ�ķ����� ��
��2����ҵ����õ�ⷨ��������Cr2O2-7��ˮ��ʵ����������ͼģ�����Cr2O2-7�ķ�ˮ��������Ӧʽ��Fe��2e��===Fe2+��������Ӧʽ��2H++2e��=H2����Fe2+��������Һ�е�Cr2O2��7��Ӧ����Cr3+��Fe3+���õ��Ľ������������������ɳ�����ȫ����ˮ�ĵ���ƽ��ǶȽ�����ԭ���ǣ� ��
�õ�ⷨ��������Һ��0.01molCr2O2-7ʱ�����ٵõ������������� g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ�����и������ϣ���ĩ��ѧ�Ծ��������棩 ���ͣ������
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com