
【题目】银锌纽扣电池,其电池的电池反应式为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
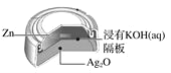
A.锌作负极
B.正极发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.电池工作时,溶液中的OH-向正极移动
科目:高中化学 来源: 题型:
【题目】桥环烷烃双环[2.2.1]庚烷的结构简式如图所示,下列关于该化合物的说法错误的是
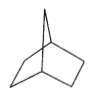
A. 与环庚烯互为同分异构体
B. 二氯代物结构有9种
C. 所有碳原子不能处于同一平面
D. 1mol双环[2.2.1]庚烷完全燃烧至少需要10 molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如下图所示:
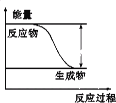
(1)该反应为_______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_________极(填“正”或“负”)。铜片上产生的现象为_________,外电路中电子由________电极(填“Fe”或“Cu”,下同),向________电极移动。
(4)若依据氧化还原反应:Cu2++Fe=Cu+Fe2+设计的原电池如下图所示,请回答下列问题:
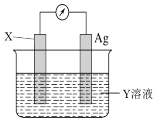
电极X的材料是________,电解质溶液Y是_________,X电极上发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘![]() 主要以I2和IO3-的形式存在
主要以I2和IO3-的形式存在![]() 废水制备单质碘的实验流程如下:
废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的硫酸钠杂质。
下列说法正确的是( )
A.操作②中发生反应的离子方程式为IO3-+3SO32-=I-+3SO42-
B.操作①和③中的有机相从分液漏斗上端倒出
C.操作④为过滤
D.操作⑤可用如图所示的水浴装置进行

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几组物质或微粒:A.![]() H和
H和![]() H;B.甲烷和乙烷;C.红磷和白磷;D.金刚石、石墨和C60;E.丁烷和异丁烷;F.
H;B.甲烷和乙烷;C.红磷和白磷;D.金刚石、石墨和C60;E.丁烷和异丁烷;F.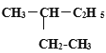 和
和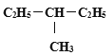
其中,属于同分异构体的是__;属于同位素的是__;属于同素异形体的是__;属于同一种物质的是___;属于同系物的是___。(填字母编号)
(2)写出分子中碳原子数小于10,一氯代物只有一种结构的所有烷烃的结构简式:___、___、___、___。
(3)把1molCH4和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:
I.在反应结束后,试管内的产物最多的是___,空间构型呈正四面体的产物为___(填化学式),写出由甲烷直接生成该物质的化学方程式:___。
II.若(3)中甲烷完全反应,且生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com