
工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
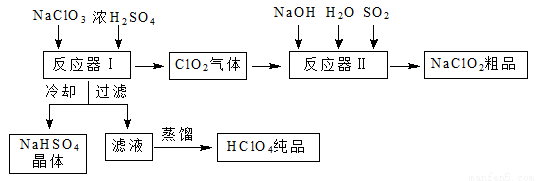
已知:① NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
② 高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上生产漂白粉的离子方程式: 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为 。(结果保留两位小数)
科目:高中化学 来源:2017届福建省高三上第一次月考化学试卷(解析版) 题型:选择题
在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH 的物质的量为b mol,下列叙述中一定正确的是
的物质的量为b mol,下列叙述中一定正确的是
A.溶质的质量分数为ω= ×100%
×100%
B.溶质的物质的量浓度c=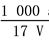 mol·L-1
mol·L-1
C.溶液中c(OH-)=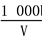 mol· L-1
mol· L-1
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是
A. 溶解后的溶液未冷却至室温就转移入容量瓶中
B. 摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平
C. 洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
D. 定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次月考化学试卷(解析版) 题型:选择题
亚氨基锂(Li2NH)时一种储氢容量大,安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2=LiNH2+LiH.下列有关说法正确的是
A.Li+和H+的离子半径相等
B.此法储氢和钢瓶储氢的原理相同
C.金属锂在空气中燃烧生成Li2O2
D.该反应中H2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次月考化学试卷(解析版) 题型:选择题
下列实验产生白色沉淀的是
①将一小块金属钠投入CuSO4溶液中②向足量NaOH 溶液中滴加少量硫酸铝溶液③隔绝空气向FeCl2溶液中滴加NaOH 溶液④ 向NaHCO3 溶液中投入少量熟石灰
A.②③ B.③④ C.①② D.①②③④
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次考试化学试卷(解析版) 题型:选择题
一定量的CuS和 Cu2S的混合物投入足量的硝酸中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量的NaOH溶液,产生蓝色沉淀,过滤,洗涤,灼烧,得到24.0 g CuO。若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为( )
A.18.0 L B.27.0 L C.31.4 L D.33.6 L
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次考试化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的3 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上第一次月考化学卷(解析版) 题型:选择题
有Na2CO3、AgNO3、BaCl2 、HCl及NH4NO3五瓶无标签的溶液,为鉴别它们,取四支试管分别装入一种溶液,再向上边四支试管中加入少许剩下的一种溶液,则下列表述错误的是( )
A.有三支试管出现沉淀时,则后加入的是AgNO3溶液
B.如果四支中都没有明显现象时,后加入的是NH4NO3
C.一支试管出现气体,两支试管出现沉淀时,最后加入的HCl溶液
D.若只有两支试管出现沉淀时,则后加入的是BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月检测化学卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.放电时阳极反应为: Fe(OH)3+5OH--3e-= FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时的正极在充电时应接电源正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com