
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。

下列溶液中的关系中正确的是( )
A.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】AB
【解析】
25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示,可知CN-、HCN含量相等时,溶液呈碱性,说明HCN电离程度小于CN-水解程度,向10mL0.01molL-1NaCN溶液中逐滴加入0.01molL-1的盐酸,其pH变化曲线如图乙所示,当加入盐酸5mL时,溶液组成为NaCN、HCN,溶液呈碱性,加入盐酸10mL时,完全反应生成HCN,溶液呈酸性,据此分析解答。
A.a点的坐标为(9.5,0.5),则a点c(HCN)=c(CN-),NaCN的水解平衡常数K(NaCN)=![]() =c(OH-)=10-4.5mol/L,故A正确;
=c(OH-)=10-4.5mol/L,故A正确;
B.图甲中pH=7的溶液中c(H+)=c(OH-),由溶液的电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),结合物料守恒c(Na+)=c(HCN)+c(CN-)可知:c(Cl-)=c(HCN),故B正确;
C.图乙中b点反应生成等浓度的NaCN、HCN,溶液呈碱性,则HCN电离程度小于CN-水解程度,可知c(HCN)>c(CN-),故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒c(Cl-)=c(HCN)+c(CN-),根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),故D错误;
故选AB。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知反应2X(g)+Y(g)![]() 2Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定10min内X的转化率,得到的数据如表所示,下列判断正确的是( )
2Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定10min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,v正(X)=v逆(Z)
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )
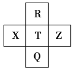
A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:

(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是________(填代号)。
a.盐酸与NaOH反应 b.Na与H2O反应生成H2
c.铝热反应 d.灼热的碳与CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,其原理图如图所示。铅蓄电池的工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+ 2H2O。下列判断错误的是( )
2PbSO4+ 2H2O。下列判断错误的是( )

A.铅蓄电池的结构中O2的作用可提高电池的工作效率
B.铅蓄电池放电时Pb电极的电极反应为:Pb-2e-=Pb2+
C.电池工作时,H+移向PbO2板
D.实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和N2O4的相互转化2NO2(g)![]() N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
Ⅰ.将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
(1)已知2NO2(g)![]() N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g)![]() N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图正确的是__________。
A. B.
B. C.
C.
(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为__________。
Ⅱ.对于2NO2(g)![]() N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ= ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=____________。
(2)利用现代手持技术传感器可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①B点时NO2的转化率为_______。
②E、H两点对应气体的平均相对分子质量ME____MH(填“<、>或=”)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为____mL。
Ⅳ.常温下,将a mol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_____(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知:
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com