
酚酞的结构如下图所示,有关酚酞说法不正确的是( )

A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1 mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值分别为10 mol 和4 mol
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解池:2Al+3H2O  Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
某探究性学习小组设计如右图所示装置分别进行如下探究实验,请回答下列问题:
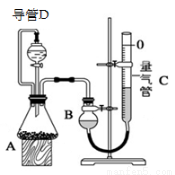
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | NaOH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是 ;
(2)实验Ⅱ中量气管中的液体最好是 (填字母编号, 下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是 ;
(3)①写出实验Ⅲ中涉及的离子反应方程式 ;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是 ,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。实验前,如拆去导管D,测得的气体体积将 (填“偏大”、“偏小”、或“无影响”)。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
“纳米技术”广泛应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳
米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
查看答案和解析>>
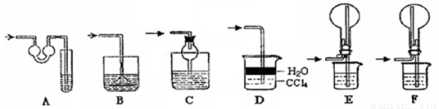
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:实验题
(每空2分,共10分)绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:

(1)洗涤中Na2CO3的主要作用是_____________。
(2)结晶过程中需要加热蒸发溶剂,加热到_____________(填字母)时,停止加热,冷却结晶。
A.沸腾 B.液体表面出现晶膜
C.析出少量晶体 D.快蒸干,还有少量液体
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,过滤速度较快的原因是___。

(4)用无水乙醇洗涤的目的是①___________,②__________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:选择题
下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO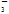 )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH 、AlO
、AlO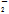 、Cl-、NO
、Cl-、NO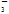
B.在由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO
C.在加入铝粉产生H2的溶液中:SO 、NO
、NO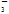 、Na+、NH
、Na+、NH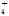
D.在使红色石蕊试纸变蓝的溶液中:SO 、CO
、CO 、Na+、K+
、Na+、K+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏时,温度计水银球靠近蒸馏烧瓶的底部
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.检验溶液中是否含有NH4+:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
在一定条件下发生反应3A(g)+2B(g)  zC(g)+2D(g),在2 L 的密闭容器中把 4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
zC(g)+2D(g),在2 L 的密闭容器中把 4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
A.z=4 B.B 的转化率是40%
C.A 的平衡浓度是1.4 mol·L-1 D.平衡时气体压强是原来压强的0.9
查看答案和解析>>
科目:高中化学 来源:2016届浙江省深化课程改革协作校高三上学期11月期中联考化学试卷(解析版) 题型:填空题
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。
已知:ⅰ CO的标准燃烧热:-283.0 kJ•mol-1,
ⅱ 1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量
ⅲ 2CH3OH(g)+CO2 (g) 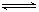 CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
则2CH3OH(g)+CO (g)+ 1/2O2(g) 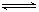 CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
(2)甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g) 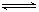 CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
① 写出该反应平衡常数表达式: 。
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是 (选填编号)。
A.v正(CH3OH)= 2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变
D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如下左图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。
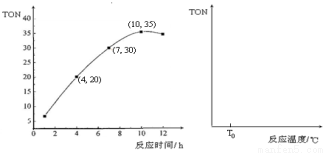
在该温度下,最佳反应时间是 ;4~10 h内DMC的平均反应速率是_ ___。
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在右上图坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)。
⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是 。
A.往反应体系中添加催化剂
B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2
D.扩大容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com