
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有吸水性,可用于干燥CO2 | |
| C. | 铝具有高熔点,可用于生产耐火砖 | |
| D. | 硅有导电性,可用作光导纤维 |
分析 A.氨气与HCl反应生成氯化铵固体;
B.浓硫酸具有吸水性,常用作干燥剂,不能干燥碱性、还原性气体;
C.氧化铝熔点高;
D.光导纤维成分是二氧化硅.
解答 解:A.氨气与HCl反应生成氯化铵固体,其现象是产生大量的白烟,可用于检查HCl泄漏,与氨气的还原性无关,故A错误;
B.浓硫酸具有吸水性,与二氧化碳不反应,可以干燥二氧化碳,故B正确;
C.氧化铝的熔点很高,一般条件下不熔融,所以氧化铝能作耐火砖,故C错误;
D.光导纤维成分是二氧化硅,不是硅,故D错误;
故选:B.
点评 本题考查了物质间的关系及用途,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O含有电子数为10NA | |
| B. | 常温下,4.6 g Na和足量的O2完全反应失去电子数为0.2NA | |
| C. | 标准状况下,11.2 LNO和11.2 L O2混合后气体的分子总数为NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
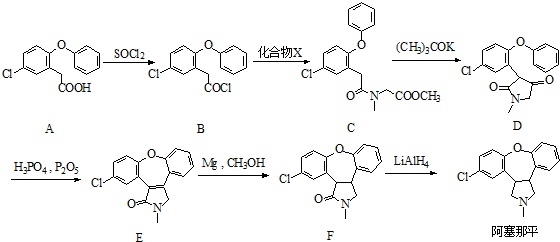
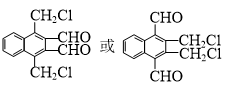 .
.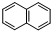 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;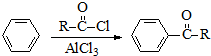 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和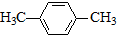 为原料制备
为原料制备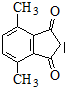 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氢能替代化石燃料 | |
| B. | 工业含氮废水经处理达标后排放 | |
| C. | 农作物秸秆等露天焚烧制肥料 | |
| D. | 金属、塑料、玻璃、纸类等制品应分类回收处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
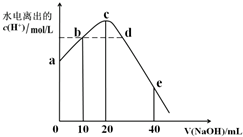
| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | a、d对应的纵坐标数值分别是:>10-12、>10-7 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向AlCl3溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| C. | 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列关于实验基本操作的叙述,不正确的是
A. 用蒸发皿进行加热蒸发时,不需要垫石棉网即可直接进行加热
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生局部过热而暴沸
C. 蒸馏时,冷凝水应从冷凝管上口进,下口出
D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com