
| A. | 饱和(NH4)2SO4、CuSO4溶液都能使蛋白质溶液发生盐析 | |
| B. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| C. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| D. | 福尔马林、葡萄糖都能发生银镜反应 |
分析 A.CuSO4溶液能使蛋白质溶液发生变性;
B.肥皂在结构上含有亲水基(-COONa)和亲油基(-R);
C.相对分子质量在10000以上的有机化合物为高分子化合物;
D.甲醛和葡萄糖都含有醛基.
解答 解:A.饱和(NH4)2SO4溶液能使蛋白质溶液发生盐析,CuSO4溶液能使蛋白质溶液发生变性,故A错误;
B.肥皂的主要成分是高级脂肪酸钠,它是油脂在碱性条件下的水解产物,在结构上含有亲水基(-COONa)和亲油基(-R),故B错误;
C.单糖、低聚糖、油脂相对分子质量较小,不是高分子化合物,多糖和蛋白质是天然高分子化合物,故C错误;
D.甲醛和葡萄糖都含有醛基,都能与银氨溶液发生银镜反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,涉及蛋白质的盐析和变性、肥皂去污的原理、天然高分子化合物、葡萄糖的特征反应等,综合性较强,侧重分析与应用能力的考查,题目难度不大.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤、石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 太阳能发电过程中具有重要作用的半导体材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ⑥⑦ | C. | ⑤⑥⑦ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
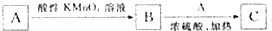 ,若A、B的碳骨架相同,则C的结构最多有
,若A、B的碳骨架相同,则C的结构最多有| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com