
 Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )| A.保持体积不变,充入Ne使体系压强增大 | B.将容器的体积缩小一半 |
| C.压强不变,充入Ne使容器的体积增大 | D.保持体积不变,充入水蒸汽 |
科目:高中化学 来源:不详 题型:单选题
 ?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是| A.减压 | B.降温 | C.加压 | D.增大B的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


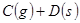 正反应速率加快的是( )
正反应速率加快的是( )| A.减少C或D的物质的量 | B.体积不变充入氦气使压强增大 |
| C.减少B的物质的量 | D.增大A或B的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10℃时,块状锌与3 mol/L硫酸溶液反应 |
| B.30℃时,粉末状锌与3 mol/L硫酸溶液反应 |
| C.10℃时,粉末状锌与3 mol/L硫酸溶液反应 |
| D.30℃时,块状锌与3 mol/L硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
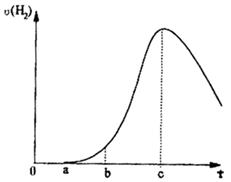
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (OE)、
(OE)、 (EF)、
(EF)、 (FG)表示)哪个最快______________;
(FG)表示)哪个最快______________;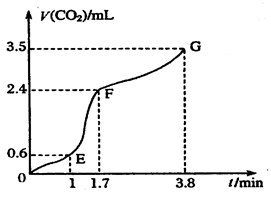
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热 | B.加入硝酸钠固体 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁屑 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 O2(g) ΔH
O2(g) ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为 。计算
。计算 N2(g)+3H2(g)的平衡常数为
N2(g)+3H2(g)的平衡常数为  。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com