
| A. | 3m+nmol | B. | 3m+$\frac{n}{2}$mol | C. | $\frac{3m+3p+n}{2}$mol | D. | $\frac{3m+n}{2-3p}$mol |
分析 混合气体消耗氧气的体积取决于C、H元素的物质的量,反应前后C、H原子的物质的量不变,则所得平衡混和气体完全燃烧消耗氧气的量与原乙烯和氢气的混合气体消耗氧气的量一定相等,据此进行计算.
解答 解:m mol C2H4、b mol H2的混合气体完全燃烧消耗氧气的总物质的量为:mmol×(2+$\frac{4}{4}$)+nmol×$\frac{2}{4}$=(3m+$\frac{n}{2}$)mol,
根据质量守恒定律,加成反应前后C、H原子的物质的量不变,则所得平衡混和气体完全燃烧消耗氧气的量与原乙烯和氢气的混合气体消耗氧气的量一定相等,都为(3m+$\frac{n}{2}$)mol,
故选B.
点评 本题考查了混合物的计算,题目难度不大,注意掌握质量守恒定律在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力,要求学生平时多积累化学计算的方法与技巧.


科目:高中化学 来源: 题型:解答题
 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: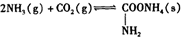
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 | |
| D. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 在铁件上镀铜时,金属铜作阴极 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是AgNO3稀溶液 | D. | A是Ag,B是Fe,C是AgNO3稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化成化学能 | |
| B. | 该电池中a是正极 | |
| C. | 外电路中的电子由电极b通过导线流向a | |
| D. | 该电池的总反应为:2H2+O2═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com