


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
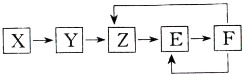 ���ֳ�������X��Y��Z��E��F������ͬһԪ��M����֪Y�ǵ��ʣ�Z��NO��һ������������һ������������������ת����ϵ�������ƶ��в��������ǣ�������
���ֳ�������X��Y��Z��E��F������ͬһԪ��M����֪Y�ǵ��ʣ�Z��NO��һ������������һ������������������ת����ϵ�������ƶ��в��������ǣ�������| A��X������һ���⻯�� | B��M�����ǽ��� | C��E������һ����ɫ���� | D��X��Y�����Ƿ�������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ��ƶ���

 M3+ (aq) + 3OH-(aq) �����£�M(OH)3���ܶȻ�Ksp = 4.0 �� 10-38��ҪʹM3+����Ũ�Ƚ���10-5mol/L����Һ��PHӦ����_________�� (lg2=0.3,lg5=0.7)
M3+ (aq) + 3OH-(aq) �����£�M(OH)3���ܶȻ�Ksp = 4.0 �� 10-38��ҪʹM3+����Ũ�Ƚ���10-5mol/L����Һ��PHӦ����_________�� (lg2=0.3,lg5=0.7) �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ��ƶ���


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ��ƶ���

��ش��������⣺
(1)��X��Y��Z��Ϊ����Ԫ�صĻ����M�Ļ�ѧʽ������__________________��
(2)��M�ǵڢ�A��ijԪ�ص�����������MΪ���壬���X���������Ӿ�����10�����ӡ�Y��Һ������Ũ�ȴ�С˳��Ϊ��__________________��
(3)��X��һ�ֻ���ɫ���壬M��һ�ֳ���������д��Z��Y�����ӷ���ʽ��_____________________��
(4)��X��Y��Z�ж�������Ԫ�أ���֪���������Ȼ�ѧ����ʽ��
Xת��ΪY��2H2S(g)+O2(g)=2S(s)+2H2O(l) ��H=-Q1kJ/mol��
Xת��ΪZ��2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H=- Q2 kJ/mol
��д��X��Z��Ӧת��ΪY���Ȼ�ѧ����ʽ��_____________________��
(5)��X��Y��Z�о�����NԪ�أ����ڳ�ѹ�°��������ú���ϡ�͵�Y���壬�ֱ�ͨ��һ�����ȵ�570��ĵ����У����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫�����ɺϳ�X���壨װ����ͼ����
�����ڵ�ⷨ�ϳ�X�ĵ�����_______����ܡ����ܡ�����ˮ���������Һ���ܼ����ٵ缫A�ǵ��ص�______�������������������
�ڸü��ϵĵ缫��Ӧʽ��______________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com