
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
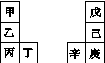
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
材料(选修三课本第42页实验2-2):向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)水分子在特定条件下容易得到一个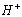 ,形成水合氢离子(
,形成水合氢离子(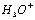 )。下列对上述过程的描述合理的是 。
)。下列对上述过程的描述合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(2)写出Cu2+的外围电子排布式 ,与铜同一周期的所有元素的基态原子中最外层电子数与铜原子相同的其它元素有 (填元素符号)。
(3) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。
(4)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(5)实验过程中加入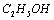 后可观察到析出深蓝色
后可观察到析出深蓝色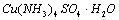 晶体。实验中所加
晶体。实验中所加 的作用是__________________________________________________
的作用是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该 化合物水解的化学方程式为_________________;
化合物水解的化学方程式为_________________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
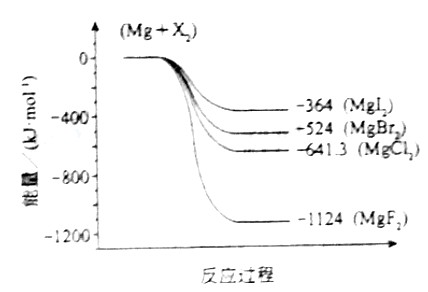
下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
[答案](1)MgO,Mg3N2;(2)+2,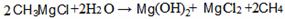 ;
;
(3) ①②③⑤
①②③⑤
命题立意:以元素及其化合物为载体的综合考查,包括物质性质及反应方程式、特殊图表信息的处理。

查看答案和解析>>
科目:高中化学 来源: 题型:
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下 ,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)
,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=______________________。
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为_______________________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①_______________________;②_______________________。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是_______________________。
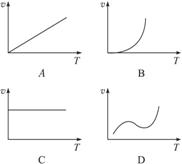
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:____________________________________。欲使上述体系中Al3+浓度增加,可加入的物质是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )
| A | CH3CH3+Cl2 CH2===CH2+HCl―→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-===2Cl-+Br2 Zn+Cu2+===Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O===4NaOH+O2↑ Cl2+H2O===HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl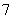 和AlCl
和AlCl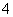 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com