
【题目】有两种有机物Q(![]() )与P(
)与P(![]() ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )
A. 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2
B. 二者在NaOH醇溶液中均可发生消去反应
C. 一定条件下,二者在NaOH溶液中均可发生取代反应
D. Q的一氯代物只有1种、P的一溴代物有2种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。
实验(一)

实验(二) 另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)步骤X的实验操作名称为_________,所用到的主要仪器有________。
(2)下列有关步骤Y的说法,正确的是_______________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要实验操作为过滤 D.NaOH溶液可以由乙醇代替
(3)步骤Z中加入了H2SO4溶液,请写出发生反应的离子方程式_________________。
(4)实验(二) 中操作W的名称是________________。
(5)方案甲中采用蒸馏不合理,理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A是现代社会中用量最多的金属,F为红褐色沉淀。根据下图的转化关系回答下列问题:
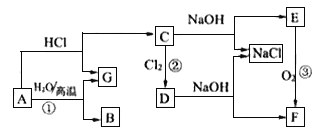
(1)写出下列物质的化学式:
C_________,E____________。
(2)分别写出反应①、反应③的化学方程式:________;________。
(3)写出反应②的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某品牌方便面包装上的部分说明.
品名 | ××方便面 |
部分配料 | ①食盐 ②姜黄 ③牛肉 ④脱水菠菜等 |
保质期 | 六个月(置于阴凉干燥处) |
生产日期 | 标示于包装外袋上 |
上表所列配料中,属于调味剂的是(填序号,下同),属于着色剂的是 , 富含蛋白质的是 , 富含维生素的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年新课标3】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种物质,根据已学的知识,回答下列问题:
(1)氮原子的核外电子排布式是___________,其最外层电子有_____种不同的运动状态。
(2)氮气在常温常压下是很稳定的,对此的合理解释是____________________。
(3)N元素处于同一主族的P、As元素,这三种元素形成的气态氢化物的稳定性由大到小的顺序是________________________。
(4)工业上常用氮气与氢气来合成氨气,温度控制在400~500 ℃,采用铁触媒做催化剂,压强控制在2 ⅹ 105 ~ 5 ⅹ 105 Pa。
①该反应的化学方程式为_____________________。
它的平衡常数表达式为_______________________。
②在一体积为10 L的密闭容器中充入了280 g N2,100 g H2,反应半小时后,测得有34 g NH3生成,则用H2表示该反应的速率为_________mol/(Lmin)。此时,氮气的转化率为__________。
③下列判断可以作为该反应达到平衡的标志的是(_______)
A.单位时间内每消耗1摩尔氮气的同时消耗3摩尔氢气
B.混合气体的平均分子量不再发生变化
C.混合气体的密度保持不变
D.体系的温度不再变化
④当反应达到平衡后的t2时刻,将混合气体通过“分子筛”,可以及时将产物NH3分理出平衡体系,这会使得平衡正向移动,请根据平衡移动原理,在下图中画出t2时刻后平衡移动的示意图:_____________

⑤当及时分离出氨气后,工业上常常将氮气、氢气再次转移到反应器,这样做的原因是________________。
⑥氨气常用来生产化肥NH4Cl,NH4Cl溶于水会使得溶液显__________性,在该盐的水溶液中存在多种微粒:NH4+、NH3H2O、H+、Ci-,这些离子浓度由大到小的顺序为_________;该盐溶液中还存在多种守恒,请任意写出一种合理的守恒关系式___________________。
⑦工业上常用氨气来制备硝酸,其中第1步是用氨气与纯氧在Cr2O3的催化作用下制得NO和水。请写出这个反应的化学方程式并配平______________________。该反应中,还原剂是_________________,若反应中转移了1.204 ⅹ 1024 个电子,则生成的 NO在标准状况下的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。

(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A、蒸馏水B、NaCl固体C、NaCl溶液D、浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com