
【题目】下列实验装置设计正确、且能达到目的的是

A. 实验I:检查装置的气密性
B. 实验II:测定未知盐酸的浓度
C. 实验III:比较硫、碳、硅三种元素的非金属性强弱
D. 实验IV:定容
【答案】AC
【解析】
A.关闭止水夹,通过长颈漏斗向烧瓶中加入水, 若装置不漏气,就会在长颈漏斗中形成一段稳定的水柱,因实验I:此检查装置的气密性,A正确;
B.实验II:测定未知盐酸的浓度时,盛装NaOH溶液应该用碱式滴定管,而且不能伸入到锥形瓶内,B错误;
C.硫酸的酸性强于碳酸,所以把硫酸滴入到盛有Na2CO3溶液中,会发生反应产生CO2,硫酸没有挥发性,产生的CO2进入到Na2SiO3溶液中,由于酸性H2CO3>H2SiO3,所以会发生反应产生难溶液水的硅酸沉淀,故实验III:可以比较硫、碳、硅三种元素的非金属性强弱,C正确;
D.实验IV:定容时向容量瓶中加水一个用玻璃棒引流,当液面至离刻度线1-2cm水再改用胶头滴管滴加,D错误;
故选AC。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为______。
(2)0.1mol烷烃E完全燃烧,消耗标准状况下的O211.2L,其分子式为______。
(3)用相对式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)立方烷![]() 其分子式为______,它的六氯代物有______种。
其分子式为______,它的六氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在电极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-===2O2-)。

(1)c电极作________极,d电极上的电极反应式为_________________________________。
(2)如下图所示用惰性电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为_________,若a电极产生56mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是三种有机物的结构简式,下列说法正确的是( )
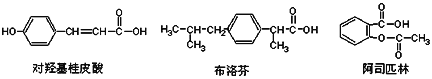
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:
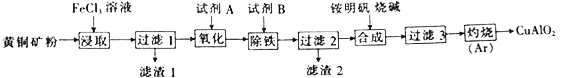
已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________(填代号)
a | b | c | d | |
A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
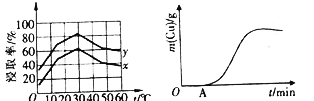
在20℃时,1L溶液中有效碰撞总次数:x_________y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:![]() 用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是_________________________________。
(3)已知在碱性溶液中可发生如下反应![]() ,则
,则![]() 中R的化合价是________。
中R的化合价是________。
A.+3 B.+4 C.+5 D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢 i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。),属于电解质的为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4 酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
①还原产物为_____。
②被氧化的元素是_____
③氧化剂与还原剂的物质的量之比为_____
④每生成 2.24 L(标况下)SO2,转移电子数目是_____
(2)用 KMnO4 酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。写出该离子反应方程式_____
(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1811年,阿伏加德罗在大量实验基础上得出结论:同温同压下,相同体积的任何气体都含有相同数目的分子。根据这个结论,下列叙述不正确的是( )
A.同温同压下,等质量的氮气和一氧化碳体积相同
B.同温同压下,等体积的两种气体原子数不一定相等
C.同温同压下,气体的体积与分子数成正比
D.两种分子数和体积都相等的气体,所处的温度和压强一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。
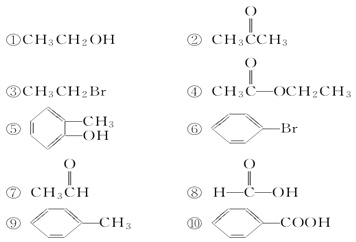
(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com