
Ⅰ.如图1为向25mL 0.1mol•L﹣1NaOH溶液中逐滴滴加0.2mol•L﹣1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项 (选填字母).
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
(3)AB区间,c(OH﹣)>c(H+),则c(OH﹣)与c(CH3COO﹣)大小关系是 .
A.c(OH﹣)大于c(CH3COO﹣) B.c(OH﹣)小于c(CH3COO﹣)
C.c(OH﹣)等于c(CH3COO﹣) D.上述三种情况都可以
(4)在D点时,溶液中c(CH3COO﹣)+c(CH3COOH) 2c(Na+)(填“>”“<”或“=”).
Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10﹣amol•L﹣1,c(OH﹣)=10﹣bmol•L﹣1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为 .
(6)该温度下(t℃),将100mL 0.1mol•L﹣1的稀H2SO4与100mL 0.4mol•L﹣1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH= .
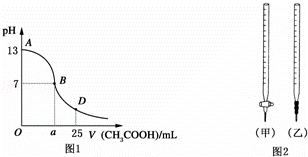
考点:
中和滴定;酸碱混合时的定性判断及有关ph的计算.
专题:
电离平衡与溶液的pH专题.
分析:
(1)NaOH与CH3COOH恰好完全反应,生成醋酸钠,醋酸钠为强碱弱酸盐,水解后溶液显碱性,pH>7;
(2)根据本实验是酸滴定碱,酸式滴定管用来盛放酸,碱式滴定管用来盛放碱,强酸滴定弱碱时应选用酚酞作指示剂来分析;
(3)在AB区间内,包括CH3COOH和NaOH恰好完全反应以及CH3COOH不足,氢氧化钠溶液过量溶液显碱性两种可能性;
(4)在D点时,NaOH和CH3COOH反应后剩余CH3COOH,溶液的组成为等浓度的CH3COOH和CH3COONa的混合物;
(5)根据水的离子积常数Kw=c(H+)•c(OH﹣)来计算;
(6)根据计算得出酸碱反应后碱过量,根据反应后的剩余的碱的物质的量,求出c(OH﹣),然后根据水的离子积常数计算c(H+),最后求出pH.
解答:
解:(1)NaOH与CH3COOH恰好完全反应:NaOH+CH3COOH=CH3COONa+H20,生成的醋酸钠为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,
故答案为:否;AB;
(2)A、酸滴定碱,滴定管应该为酸式滴定管,故A错误;
B、碱滴定酸,碱不能盛放在甲酸式滴定管中,应该使用乙﹣碱式滴定管,故B错误;
C、酸滴定碱,酸盛放在酸式滴定管中,指示剂不能使用石蕊,应该选用酚酞,故C错误;
D、碱滴定酸,碱盛放在碱式滴定管中,指示剂选用酚酞,故D正确;
故选D;
(3)在AB区间内,c(OH﹣)>c(H﹣),说明溶液显碱性,当NaOH和CH3COOH恰好反应时,显碱性,此时生成的溶液可能为醋酸钠,c(OH﹣)小于c(CH3COO﹣);当NaOH和CH3COOH反应后剩余NaOH,溶液仍然显碱性,此时若剩余的NaOH量很大,则c(OH﹣)大于c(CH3COO﹣),也有可能剩余的NaOH和CH3COONa中CH3COO﹣水解之后剩余的CH3COO﹣的浓度相等,
故选D;
(4)在D点时,反应后CH3COOH剩余,溶液的组成为等浓度的CH3COOH和CH3COONa的混合物,根据物料守恒,此时:c(CH3COO﹣)+c(CH3COOH)=2c(Na+),
故答案为:=;
(5)水的离子积常数Kw=c(H+)•c(OH﹣)=10﹣a×10﹣b=10﹣(a+b)=10﹣13,
故答案为:10﹣13;
(6)稀H2SO4溶液与NaOH反应的关系式:H2SO4 ~2NaOH
1 2
100mL×0.1mol•L﹣1 100mL×0.4mol•L﹣1
碱过量,过量的碱为:0.02mol,则c(OH﹣)= =0.1mol•L﹣1,所以c(H+)=
=0.1mol•L﹣1,所以c(H+)=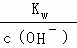 =
=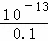 mol/L=10﹣12mol•L﹣1,则pH=12,
mol/L=10﹣12mol•L﹣1,则pH=12,
故答案为:12.
点评:
本题主要考查了中和滴定操作以及溶液中PH的计算,题目难度中等,注意掌握酸碱中和反应后溶液pH的计算方法、中和滴定操作方法,试题培养了学生灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在BaSO3(s)⇌Ba2+(aq)+SO32﹣ (aq)平衡体系中,下列措施可使沉淀量减少的是( )
|
| A. | 加入K2SO3(s) | B. | 加入稀HNO3 | C. | 加入稀盐酸 | D. | 加入K2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJ•mol﹣1、P﹣O:b kJ•mol﹣1、P=O:c kJ•mol﹣1、O=O:d kJ•mol﹣1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
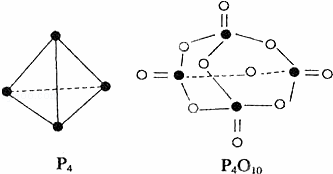
|
| A. | (6a+5d﹣4c﹣12b)kJ•mol﹣1 | B. | (4c+12b﹣6a﹣5d)kJ•mol﹣1 |
|
| C. | (4c+12b﹣4a﹣5d)kJ•mol﹣1 | D. | (4a+5d﹣4c﹣12b)kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,固定体积的容器中充入1mol SO2和1mol O2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是( )
|
| A. | 体系中的总反应是:2SO2+O2⇌2SO3 |
|
| B. | 在反应过程中NO是催化剂 |
|
| C. | NO参与反应历程,降低反应活化能,加快反应速率 |
|
| D. | NO的引入可以增加SO2的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)⇌N2O4(g)△H=﹣57.20kJ•mol﹣1.
一定温度下,在密闭容器中反应2NO2(g)⇌N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是 (填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
②下表为反应2NO2(g)⇌N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol•L﹣1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol•L﹣1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
该温度下反应N2O4(g)⇌2NO2(g)的平衡常数K的值为 .
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O |
|
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O |
|
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O |
|
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com