


科目:高中化学 来源: 题型:
| A、F的浓度为1.5mol/L |
| B、F的浓度为1mol/L |
| C、N的浓度为2.5mol/L |
| D、N的浓度为3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol
(Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上常用天然气作为制备甲醇CH3OH的原料.已知:
工业上常用天然气作为制备甲醇CH3OH的原料.已知:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
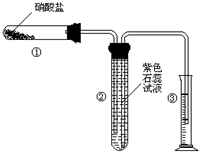 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结 论 | |
| A | 加热的铝箔熔化,但液态的铝不滴落 | 熔点:氧化铝>铝 |
| B | 溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 碳酸钠溶液能使酚酞试液变红 | 碳酸钠溶液呈碱性 |
| D | 常温下,铜与冷的浓H2SO4不反应 | 铜与浓硫酸发生钝化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com