
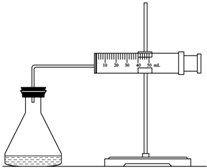
 ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��| ʵ���� �Լ� |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ���ݵ�����У�߶���ѧ������������ѧ�Ծ����������� ���ͣ�ʵ����
��9�֣�ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
| ʵ���� �Լ� | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�鱦�и�һ��ѧ�ڵڶ��μ�⻯ѧ�����Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ��Ӧ���ʺ��ȵ�˵���У�����ȷ����
A��ʵ������H2O2�ֽ���O2������MnO2��Ӧ�������Լӿ�
B���ڽ�����������ˮ��Ӧ�У�����ˮ�����ܼӿ췴Ӧ����
C��2SO2+O2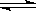 2SO3��Ӧ�У�SO2��ת���ʲ��ܴﵽ100%
2SO3��Ӧ�У�SO2��ת���ʲ��ܴﵽ100%
D��ʵ������̼��ƺ����ᷴӦ��ȡCO2����̼��Ʒ�ĩ�ȿ�״��ӦҪ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com