
(10��)��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g)��2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII��CO2(g)��3H2(g) CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
|
�¶� |
250�� |
300�� |
350�� |
|
K |
2.041 |
0.270 |
0.012 |
�ɱ��������жϦ�H1 0�����������������������
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)��0.2mol��L����CO��ת����Ϊ ��
��2��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�
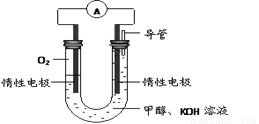
�� �õ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�����ӷ���ʽΪ ��
��1���� I �� �� �� 80%
��2���� O2 +2H2O +4e- = 4OH- �� 2CH3OH +3O2 +4OH-= 2CO32- + 6H2O
����������1���ٸ��ݷ�Ӧʽ��֪����ӦI�з�Ӧ��ȫ������״��У����Է���ԭ�Ӿ�����ԭ��
�ڸ������ݿ�֪�������¶ȵ����ߣ�ƽ�ⳣ����С��˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ��
��ƽ��ʱCO��0.2mol��L��2L��0.4mol��������CO��2mol��0.4mol��1.6mol������CO��ת������1.6��2.0��100����80����
��2����ԭ����������ǵõ����ӵģ���������������ͨ�룬��������ӦʽΪO2 +2H2O +4e- = 4OH- ��
�ڸ���ʧȥ���ӣ����״��ڸ���ͨ�룬�״�������������̼��أ������ܷ�ӦʽΪ2CH3OH +3O2 +4OH-= 2CO32- + 6H2O��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com