
G.H.盖斯,根据一系列事实于1840年提出“不管化学过程是一步或分数步完成,这一过程热效应相同”.换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同.应用这个原理,解决下列问题:
已知:C(s)+O2(g)=CO2(g) ?H=-393.5 kJ/mol
CO(g)+1/2O2(g)=CO2(g) ?H=-283 kJ/mol
写出C(s)与O2(g)反应生成CO(g)的热化学方程式:_____________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
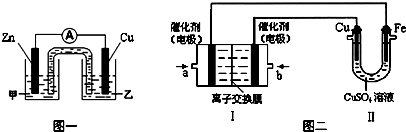
查看答案和解析>>
科目:高中化学 来源: 题型:
瑞士化学家盖斯,根据一系列事实于1840年提出:不管化学反应是一步或分数步完成,这一过程的热效应相同。换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同。应用这个原理,已知:C(s)+O2(g)=CO2(g) ∆H= -393.5kJ/mol;CO(g)+1/2 O2(g)=CO2(g) ∆H= -283kJ/mol;则C(s)与O2(g)反应生成1molCO(g)的反应热为
A. ∆H= -676.5kJ/mol B. ∆H= +676.5kJ/mol
C. ∆H= -110.5kJ/mol D.∆H= +110.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com