
【题目】把铁和氧化铁组成的某混合物放入250 mL 2.0 mol·L-1的硝酸溶液中,充分反应后,生成的一氧化氮气体在标准状况下的体积为1.12 L,再向反应后的溶液中加入1.0 mol·L-1的氢氧化钠溶液,要使铁元素完全沉淀下来,加入的氢氧化钠溶液的体积最少是
A.400 mLB.450 mLC.500 mLD.550 mL
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。
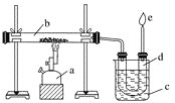
(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 MnO2是一种重要的无机功能材料,工业上提纯粗MnO2(含有较多的MnO和MnCO3)实验工艺流程如下图,则下列说法不正确的是
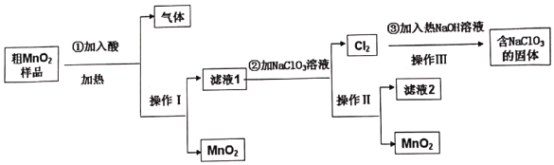
A.若①加入的是稀H2SO4,实际生产中可由滤液2进一步制得副产品Na2SO410H2O
B.操作Ⅲ是减压蒸发,理论上得到的固体NaCl和NaClO3物质的量之比为5:1
C.①加酸的目的是溶解MnO和MnCO3,实际生产可以用浓盐酸进行溶解
D.②反应的离子方程式:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
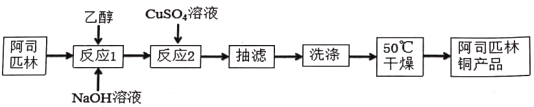
已知反应方程式如下:
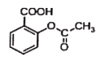 +NaOH→
+NaOH→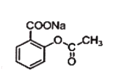 +H2O
+H2O
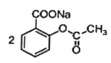 +CuSO4→
+CuSO4→ +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 气体的总物质的量
C. 混合气体的密度 D. 单位时间内生成n molC的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学、环境保护和人类健康是息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是________(填序号)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中有剧毒的CN-氧化成无毒气体的离子方程式:____________________并说明该方法的优点:_____________________________________。
(3)如图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
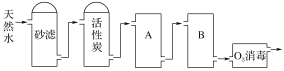
活性炭的作用是____________________;用O3消毒的优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.9g超重水(3H216O)含中子数为6NA
B.标准状况下,22.4L CCl4含有的分子数目为NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.一定条件下,将1mol N2和3mol H2混合,充分反应后转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素如Fe、Mn、Cu、Ni可用作很多反应的催化剂,在室温下以H2O2为氧化剂直接将CH4氧化,回答下列问题:
(1)基态铜原子的核外电子排布式是___,第四周期元素中,基态原子未成对电子数最多的元素是____(填元素符号)
(2)C、H、O、Fe四种元素的电负性由大到小的顺序是____
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO等
①CH3OH和HCHO的沸点分别是64.7℃、-19.5℃,其主要原因是____
②CH4、HCHO的键角较大的是___,原因是______
(4)Cu2+可与乙二胺(NH2CH2CH2NH2,简写为en)形成配合物,化学式为Cu(en)22+,乙二胺中与Cu2+形成配位键的原子是___(填元素符号),该配合物的配位数是__
(5)Cu晶胞结构如图所示,已知铜原子半径为apm,阿伏加德罗常数用NA表示,则铜晶体的密度为____g/cm3(写出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中碳酸钠的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为____________。
(2)实验中,需加热至恒重的目的是_____________。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为__________。
(2)实验中判断沉淀是否完全的方法是__________。
[方案三]按如下图所示装置进行实验:
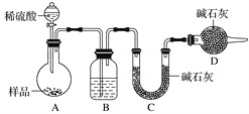
(1)D装置的作用是________,分液漏斗中_____(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中碳酸钠的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com