
【题目】下列说法中正确的是( )
A.过量的铜与浓硝酸反应有一氧化氮生成
B.Al、Fe、Cu的单质放置在空气中均只生成氧化物
C.SiO2与酸、碱均不反应
D.向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏
B.升华
C.干馏
D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属单质跟一定浓度的硝酸反应,生成硝酸盐和氮氧化物等物质,假定只生成单一的还原产物,当参加反应的单质与被还原的硝酸的物质的量比为2:1时,还原产物可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有①0.2 mol·L-1NaOH溶液和②0.2 mol·L-1HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)__________②中由水电离出的c(H+)(填“>”、“=”或“<”)。
(2)上述混合液中共存在__________种粒子。其中:c(HX)+c(X-)__________0.1 mol·L-1(忽略混合前后溶液体积变化;填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的等式:_____________________________________。
(3)上述混合液显__________性(填“酸”、“碱”或“中”),其原因用离子方程式表示为_______________________________________。
Ⅱ.海水中含有大量的元素,常量元素(如氯)、微量元素(如碘)在海水中均以化合态存在。在25 ℃时,向0.1 mol·L-1的NaCl溶液中逐滴加入适量的0.1 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1 mol·L-1的NaI溶液,看到的现象是___________________________,产生该现象的原因是(用离子方程式表示)__________________。
[已知25 ℃时Ksp(AgCl)=1.0×10-10、Ksp(AgI)=1.5×10-16]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
(已知:氯水中含有CL2分子,Cl2 +2I- = 2Cl- + I2)
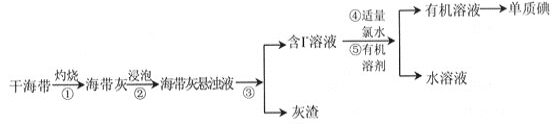
请回答:
(1)步骤①中灼烧海带用到的实验仪器是_____________(填序号)。
a. 试管 b. 坩埚 c. 烧杯 d.蒸发皿
(2)步骤③的实验操作是_______________________。
(3)步骤⑤实验操作可分解为如下几步:
(A)检验分液漏斗活塞和上口的玻璃塞是否漏水
(B)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞
(C)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把漏斗放正
(D)把盛有溶液的分液漏斗放在铁架台的铁圈中
(E)静置,分层
(F)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
(G)旋开活塞,用烧杯接收溶液
(H)从分液漏斗上口倒出上层水溶液
①上述(G)步骤的操作目的是____________________________________。
②能选用CCl4从碘水中萃取碘的原因是___________________________。
③以下物质中,能用来代替CCl4的是_______。
A汽油 B 酒精 C NaCl溶液 D NaOH溶液
(4)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
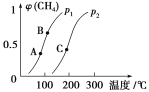
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。
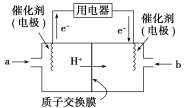
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】147 g H2SO4的物质的量是______;0.5 mol H2SO4的质量是______;其中含有_____mol H,含有_____mol O;2 mol H2SO4 中含有H2SO4分子数为______个,含有氢原子数为_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用H2和N2直接合成氨:N2+3H2=2NH3,下列措施肯定能使合成氨反应速率加快的是:
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强
A.只有①②③ B.只有①②④ C.只有①③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com