
在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
科目:高中化学 来源: 题型:
为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,回导致测定结果偏小
D.若把盐酸换成硫酸,会导致测定结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:
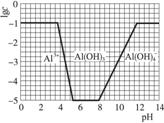
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
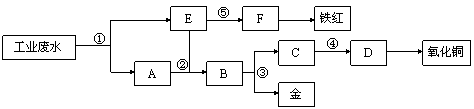
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤  ;
;
(2)写出①处发生反应的离子方程式 ;写 出③处发生反应的化学方程式 ;
出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属铝及其化合物的叙述正确的是
 A.铝在常温下不能与氧气反应
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.铝既能溶于酸,又能溶于碱
D.氧化铝只能与酸反应,不能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下一些氧化物和单质之间可发生如图所示的反应:
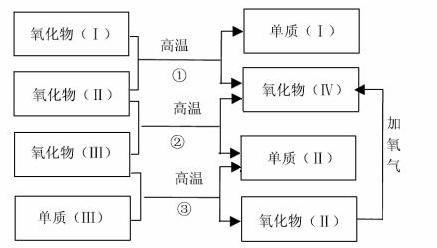
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。
氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是
。
反应②的化学方程式是 。
反应③的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
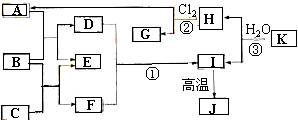
下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
⑴ 写出B的化学式_______________,G的电子式_________________。
⑵ 反应①的离子方程式为______________________________________。
⑶ 反应②进行的条件是___________________,___________________。
⑷ 反应③的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是( )
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、CO32-、Br-、ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com