

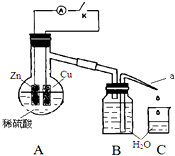
分析 (1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以干燥氯气;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,据此解答即可;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,铁和氯化铁反应需要在溶液中进行,氯气具有氧化性能氧化氯化亚铁,据此解答即可.
(4)设FeCl3和FeCl2的物质的量分别为amol,bmol,依据铁元素守恒和氯元素守恒建立方程式组来求解.
解答 解:(1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,当生成1molCl2时,转移的电子数为2NA,玻璃丝的作用是防止堵塞导气管,向500-600℃的铁屑中通入氯气生产无水氯化铁,生成的氯气需要干燥,装置B中应是浓硫酸,反应后剩余的氯气不能排放到空气中,需要用氢氧化钠溶液进行尾气吸收,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;2NA;防堵塞;浓硫酸;NaOH溶液;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,若仍用D的装置进行尾气处理易发生倒吸,氢气不能被吸收,
故答案为:HCl和H2;生倒吸;可燃性气体H2不能被吸收;
(3)A.检验氯化铁常用硫氰化钾溶液,铁离子遇到KSCN溶液生成血红色溶液,故A正确;
B.实验目的是制备无水氯化铁,加入铁粉需要在溶液中和氯化铁反应生成氯化亚铁,故B错误;
C.氯气和氯化铁不反应,和氯化亚铁反应生成氯化铁,不能得到氯化亚铁,故C错误;
D.若要制取纯净的FeCl2,需先排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,故D正确;
故答案为:A、D;
(4)FeCl3和FeCl2的物质的量分别为amol,bmol;
则有3amol+2bmol=$\frac{28.7g}{143.5g/mol}$=0.2mol(氯守恒)
amol+bmol=$\frac{6.4g}{160g/mol}$×2=0.08mol(铁守恒)
解得:a=0.04,b=0.04
FeCl3的物质的量为0.04mol,
故答案为:0.04mol.
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol37Cl2和16g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 20g D2O和10g H2 | D. | 224mL D2和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为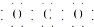 | B. | Cl-的结构示意图为 | ||
| C. | NaCl的电子式为Na+Cl- | D. | HCl的电子式为HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
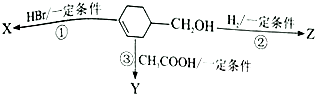 有机物
有机物 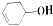 可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )
可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )| A. | 反应③的条件是稀硫酸、加热 | B. | 反应①②的类型不可能相同 | ||
| C. | 有机产物X是一种纯净物 | D. | Y、Z均可使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯 | B. | 甲烷和丙烯 | C. | 甲烷和乙烯 | D. | 丙烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的元素符号为O | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 它的氢化物的电子式为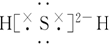 | |
| D. | 其电子排布图为 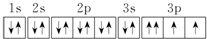 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com