
��X��Y��Z��W��M����ԭ����������Ķ�����Ԫ�أ�����X��Mͬ���壻 Z+��Y2-������ͬ�ĵ��Ӳ�ṹ��W�ǵؿ��к������Ľ�����X��W��ԭ������֮�͵���Y��Z��ԭ������֮�ͣ�������������ȷ����
A�����Ӱ뾶��С��r(Y2-)��r(W3+)
B��W���������Ӧ��ˮ�������Z�����������ˮ���ﷴӦ
C��X�ж���ͬ�������壬��Y������ͬ��������
D��X��M���������γ��ɼ��Լ����ɵ���������Ǽ��Է���
 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ȥ���������ؿ��Ե��ض�������ֲ�������ܣ���ṹ��ʽ��ͼ��ʾ������˵����ȷ����
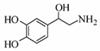 A�� ȥ���������ط���ʽΪC8H10O3N
A�� ȥ���������ط���ʽΪC8H10O3N
B�� ÿ��ȥ���������ط����к���3�����ǻ�
C��1molȥ�����������������2molBr2����ȡ����Ӧ
D��ȥ���������ؼ��������ᷴӦ������������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ������Ϊԭ���Ʊ�����Ĺ�����ͼ1��ʾ��
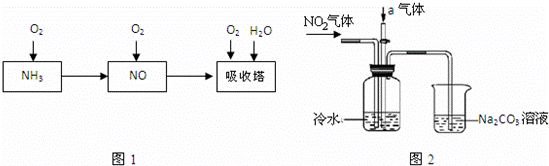
ij����С��ģ���������ֹ����������ͼ2��ʾʵ��װ���Ʊ����ᣨ��������Ʒ���ѱ�������
��1����ҵ���ð�����ȡNO�Ļ�ѧ����ʽ�� ��
��2�����Ӻ�װ�ú����Ƚ��еIJ����� ��
��3��ͨ��a�����Ŀ���� ��
��4��ʢ��Na2CO3��Һ���ձ�Ϊβ������װ�ã���װ���з�����Ӧ�Ļ�ѧ����ʽ�� ��
��5����֪���¶ȵ���21.15��ʱ��NO2����ȫ��ת��ΪN2O4����ҵ�Ͽ���N2O4��ˮ��Ӧ�����������ʣ�N2O4��a��������ˮ����������Ļ�ѧ����ʽ�� ��
��6��һ�������£�ij�ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��=0.500mol/L��c��N2O4��=0.125mol/L����2NO2��g�� N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ȼ�ѧ����ʽ��ȷ����
A�������ȼ����Ϊ890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)===CO2(g)��2H2O(g)����H����890.3 kJ��mol��1
B��500 �桢30 MPa�£���0.5 mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g)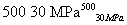 2NH3(g)����H����38.6 kJ��mol��1
2NH3(g)����H����38.6 kJ��mol��1
C����֪��120 �桢101 kPa�£�1 g H2ȼ������ˮ�����ų�121 kJ���������Ȼ�ѧ����ʽΪH2(g)��1/2O2(g)===H2O(g)����H����242 kJ��mol��1
D��25 �桢101 kPaʱ��ǿ����ǿ���ϡ��Һ������Ӧ���к���Ϊ57.3 kJ��mol��1������ϡ��Һ����������ϡ��Һ��Ӧ���Ȼ�ѧ����ʽΪ��H2SO4(aq)��2KOH(aq)�� K2SO4(aq)��2H2O(l)����H����114.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��̼��������Ҫָ����CO2���ڽ������������ŷ��о�����Ҫ�����á�ĿǰNH3�ͣ�NH4��2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��Է�Ӧ��
��Ӧ�� 2NH3(l) + H2O (l) + CO2 (g)  (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
��Ӧ�� NH3(l) + H2O (l) + CO2 (g)  NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
��Ӧ�� (NH4)2CO3(aq) + H2O (l) + CO2 (g)  2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
 ��ش��������⣺
��ش��������⣺
��1����H3���H1����H2֮��Ĺ�ϵ�ǣ���H3�� ��
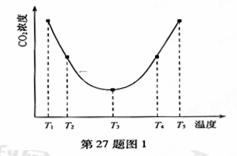
��2��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�
T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������
һ������CO2���õ�����Ϊϡ�ͼ�������tʱ�̣��������
��CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�
����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬ
ʱ����CO2����Ũ�ȣ��õ�����ͼ����ͼ1����
���H3 0(�������)��
��3�����÷�Ӧ��CO2����(NH4)2CO3��ʼŨ�Ⱥ����ȷ��������£����CO2�������Ĵ�ʩ�� ��д��2������ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ����������ƺϳɿ�������I�߷��ӻ�����G·�����£�
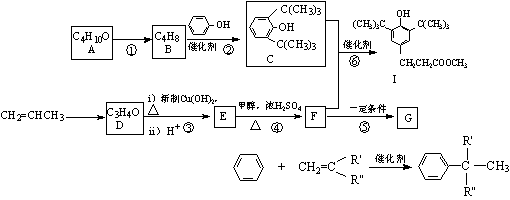 |
��֪����A�����к���3���� ��
��ش��������⣺
��1��C�ķ���ʽΪ �� A������Ϊ ��
��2����Ӧ�ٵķ�Ӧ����Ϊ ��G�Ľṹ��ʽΪ
��3��д��D������Cu(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ��
��4��������Ӧ������ȡ����Ӧ���� ������ţ�
��5��F���ڶ���ͬ���칹�壬д��������������������ͬ���칹��
���ܷ���ˮ�ⷴӦ������ʹ������Ȼ�̼��Һ��ɫ �ں˴Ź���������ʾ��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȫ�к�20 mL 1 mol /L NaOH��Һ�������ε���Һ�ǣ� ����
A��40 mL 0.1 mol /L���� B��20 mL1 mol /L������Һ
C��10 mL 1 mol /L������Һ D��5mL 1 mol /L������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ƶ�˼ά�����ڻ�ѧѧϰ���о�����ʱ�����������ۣ�������ƵĽ�������Ҫ����ʵ���� ���飬���ܾ�������ȷ������м������ƽ����У��������(����)
������ˮ��Ӧ����NaOH��H2�����н�����ˮ��Ӧ�����ɼ��H2
����¶���ڿ�����һ��ʱ���ͻ����⣻���ʸ����õ��������ȶ������ڿ�����
�ۻ�����NaCl����ɫΪ��ɫ��Na2CO3����ɫҲΪ��ɫ
���ܶ�Ϊ1.1 g��cm��3���ܶ�Ϊ1.2 g��cm��3��NaCl��Һ�������ϣ�����NaCl��Һ���ܶȽ���1.1 g��cm��3��1.2 g��cm��3֮�䣬Na��K�Ͻ���۵�Ӧ����Na��K�۵�֮��
A���٢� B���٢� C���٢ڢۢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����β����CO��NOx �Լ�ȼú�����е�SO2���Ǵ�����Ⱦ������ǵ�����������Ҫ���塣
��CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ��H1= ��574 kJ��mol- 1 ��
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) ��H2= һ1160 kJ��mol- 1
(1)����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
������SO2��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ����(CeΪ��Ԫ��)��
(2)װ�â��У����������£�NO��Ce 4+ �����IJ�����Ҫ��NO3- ��NO2- ��д��ֻ����NO3- �����ӷ���ʽ ��
(3)װ�â������֮һ������Ce4+����ԭ������ͼ��ʾ��
�����ɵ�Ce4+ �ӵ��۵� (����ĸ���)��������
������S2O42 - �ĵ缫��ӦʽΪ ��
(4)��֪����װ�â�����Һ�У�NO2- ��Ũ��Ϊa g��L- 1 ��Ҫʹ1m3����Һ�е�NO2- ��ȫת��ΪNH4NO3����������װ�â���ͨ���״���µ�O2 L��(�ú�a����ʽ��ʾ����������������)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com